本试题 “下列说法或表示方法正确的是[ ]A.等质量的硫蒸气和硫磺分别完全燃烧,后者放出的热量多B.氢气的燃烧热为285.8kJ·mol-1,则氢气燃烧的热化学方程式为2H2(g)...” 主要考查您对吸热反应、放热反应
热化学方程式
燃烧热
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 吸热反应、放热反应
- 热化学方程式
- 燃烧热
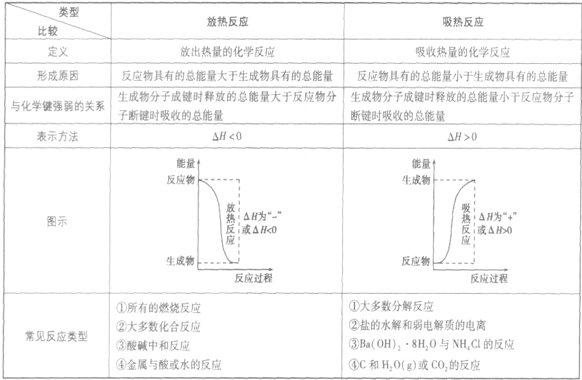
吸热反应:
吸收热量的反应,即生成物的总能量大于反应物的总能量,反应需要吸收能量
放热反应:
放出热量的反应,即生成物的总能量小于反应物的总能量,反应释放出能量
放热反应和吸热反应的比较:
吸收热量的反应,即生成物的总能量大于反应物的总能量,反应需要吸收能量
放热反应:
放出热量的反应,即生成物的总能量小于反应物的总能量,反应释放出能量
放热反应和吸热反应的比较:

热化学方程式:
1.定义表示反应所放出或吸收热量的化学方程式,叫做热化学方程式。
2.表示意义不仅表明了化学反应中的物质变化,也表明厂化学反应中的能量变化。例如: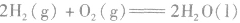 :
: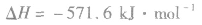 ,表示在25℃、101kPa下,2molH2(g)和1mol O2(g)完全反应生成2molH2O(l)时要释放571.6kJ 的能量。
,表示在25℃、101kPa下,2molH2(g)和1mol O2(g)完全反应生成2molH2O(l)时要释放571.6kJ 的能量。
热化学反应方程式的书写:
热化学方程式与普通化学方程式相比,在书写时除厂要遵守书写化学方程式的要求外还应注意以下问题:
1.注意△H的符号和单位 △H只能写在标有反应物和生成物状态的化学方程式的右边。若为放热反应,△H为“-”;若为吸热反应,△H为“+”。△H的单位一般为kJ/moJ。
2.注意反应条件反衄热△H与测定条件(温度、压强等)有关。因此书写热化学方程式时应注明△H的测定条件。绝大多数△H是是25℃、101kPa下测定的,此条件下进行的反应可不注明温度和压强。
3.注意物质的聚集状态反应物和生成物的聚集状态不同,反应热△H不同。因此,必须注明物质的聚集状态才能完整地体现出热化学方程式的意义。气体用“g”,液体用:l“,固体用“s”,溶液用“aq”。
4.注意热化学方程式的化学计量数
(1)热化学方程式中各物质化学式前面的化学计量数仅表示该物质的物质的量,并不表示物质的分子数或原子数,因此化学计量数可以是整数,也可以是分数。
(2)热化学方程式中的反应热表示反应已完成时的热量变化,由于△H与反应完成的量有关,所以方程式中化学式前面的化学计量数必须与△H相对应,如果化学计量数加倍,则△H也要加倍。当反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。
1.定义表示反应所放出或吸收热量的化学方程式,叫做热化学方程式。
2.表示意义不仅表明了化学反应中的物质变化,也表明厂化学反应中的能量变化。例如:
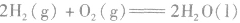 :
: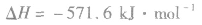 ,表示在25℃、101kPa下,2molH2(g)和1mol O2(g)完全反应生成2molH2O(l)时要释放571.6kJ 的能量。
,表示在25℃、101kPa下,2molH2(g)和1mol O2(g)完全反应生成2molH2O(l)时要释放571.6kJ 的能量。热化学反应方程式的书写:
热化学方程式与普通化学方程式相比,在书写时除厂要遵守书写化学方程式的要求外还应注意以下问题:
1.注意△H的符号和单位 △H只能写在标有反应物和生成物状态的化学方程式的右边。若为放热反应,△H为“-”;若为吸热反应,△H为“+”。△H的单位一般为kJ/moJ。
2.注意反应条件反衄热△H与测定条件(温度、压强等)有关。因此书写热化学方程式时应注明△H的测定条件。绝大多数△H是是25℃、101kPa下测定的,此条件下进行的反应可不注明温度和压强。
3.注意物质的聚集状态反应物和生成物的聚集状态不同,反应热△H不同。因此,必须注明物质的聚集状态才能完整地体现出热化学方程式的意义。气体用“g”,液体用:l“,固体用“s”,溶液用“aq”。
4.注意热化学方程式的化学计量数
(1)热化学方程式中各物质化学式前面的化学计量数仅表示该物质的物质的量,并不表示物质的分子数或原子数,因此化学计量数可以是整数,也可以是分数。
(2)热化学方程式中的反应热表示反应已完成时的热量变化,由于△H与反应完成的量有关,所以方程式中化学式前面的化学计量数必须与△H相对应,如果化学计量数加倍,则△H也要加倍。当反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。
燃烧热:
在101kPa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热。单位为kJ/mol
注意事项:
(1)规定是在101kPa 下测出的热量。书中提供的燃烧热数据都是在25℃、101kPa下测定出来的
(2)规定可燃物的物质的量为1mol(这样才有可比性)。因此,表示可燃物的燃烧热的热化学方程式中,可燃物的化学计量数为1,其他物质的化学计量数常出现分数
(3)规定生成稳定的氧化物,例如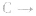
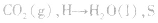
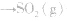 等
等
(4)叙述燃烧热时、不用“+”“-”,在热化学方程式中用△H表示时取“-”
在101kPa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热。单位为kJ/mol
燃烧热和中和热的异同:
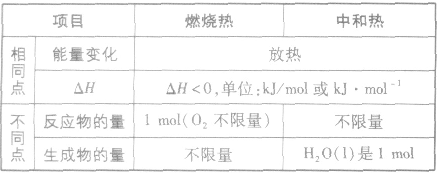
注意事项:
(1)规定是在101kPa 下测出的热量。书中提供的燃烧热数据都是在25℃、101kPa下测定出来的
(2)规定可燃物的物质的量为1mol(这样才有可比性)。因此,表示可燃物的燃烧热的热化学方程式中,可燃物的化学计量数为1,其他物质的化学计量数常出现分数
(3)规定生成稳定的氧化物,例如
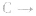
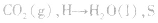
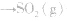 等
等 (4)叙述燃烧热时、不用“+”“-”,在热化学方程式中用△H表示时取“-”
发现相似题
与“下列说法或表示方法正确的是[ ]A.等质量的硫蒸气和硫磺分别...”考查相似的试题有:
- 下列有关物质分类或归类正确的是( )①混合物:盐酸、氯水、水银 ②化合物:CaCl2、NaOH、HD③电解质:胆矾、冰醋酸、氯化银 ④...
- 已知方程式2H2(g)+O2(g)=2H2O(l) △H1=-571.6KJ·mol-1,则关于方程式 2H2O(l) =2H2(g)+O2(g)△H2=?的说法正确的是[ ]A.方程...
- 现在城市居民使用的管道煤气的主要成分是H2、CO和少量CH4.H2、CO和CH4的燃烧热数据如下表物质H2COCH4燃烧热(kJ•mol-1)285....
- 已知下列热化学方程式:①H2(g)+1/2O2(g)=H2O(l) △H1=-285.8kJ·mol-1②H2(g)+1/2O2(g)=H2O(g) △H2=-241.8kJ·mol-1③C(s)+1/2O2(g...
- 已知25℃、101kPa下,石墨、金刚石燃烧的热化学方程式分别为:C(石墨)+O2(g)=CO2(g);△H=-393.51kJ•mol-1C(金刚石)+O2...
- (10分)(1)已知25℃时,1 g H2在氧气中完全燃烧生成液态水,放出热量142.9kJ。写出该反应的热化学方程式:________________...
- 甲醇是一种很好的燃料,工业上可用多种原料通过不同的反应制得甲醇。(1)已知在常温常压下:(2)工业上正在研究利用来生产...
- 已知(l)=H2O(g) △H1=a kJ/mol(2)=2H2O(g) △H2=b kJ/mol (3)=H2O(l) △H3=c kJ/mol(4)=2H2O(l) △H4=d ...
- (5分)已知:2H2(g)+O2(g)==2H2O(g);△H = -483.6kJ/mol;H2(g)+O2(g)==H2O(l);△H = -285.8kJ/mol,由此可知,在等温...
- 下列说法正确的是[ ]A.反应热就是反应中放出的能量B.在101 kPa时,1 mol碳燃烧所放出的热量为碳的燃烧热C.由C(石墨)→C(金...