本试题 “下列叙述正确的是[ ]A.分子晶体中一定存在分子间作用力B.阳离子都只有氧化性C.与强酸、强碱都反应的物质只有两性氧化物或两性氢氧化物D.金属与盐溶液的反...” 主要考查您对置换反应
物质的简单分类
分子晶体
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 置换反应
- 物质的简单分类
- 分子晶体
置换反应:
单质与化合物反应生成另外的单质和化合物的化学反应
发生置换反应的原理:
必须是活动性强的金属置换活动性弱的金属或H+溶液
根据元素性质分类:
1.金属单质置换金属单质:2Al+Fe2O3=高温=Al2O3+2Fe(铝热反应。Al还可与V2O5、CrO3、WO3、MnO2等发生置换);Fe+CuSO4=FeSO4+Cu
2.金属单质置换非金属单质:Zn+2HCl=H2↑+ZnCl2 ;2Na+2H2O=2NaOH+H2↑;2Mg+CO2=点燃=2MgO+C;3Fe+4H2O(g)=高温=Fe3O4+4H2
3.非金属单质置换金属单质:H2+CuO=Δ=Cu+H2O ;C+FeO=Δ=Fe+CO↑
4.非金属单质置换非金属单质:2F2+2H2O=4HF+O2 ;2C+SiO2=Si+2CO↑ ;C+H2O=高温=CO+H2 ;2H2+SiCl4=Si+4HCl ;Cl2+2NaBr=Br2+2NaCl
置换反应与氧化还原反应的关系:
置换反应一定属于氧化还原反应。
混合物、纯净物、单质、化合物的概念:
(1)混合物:由两种或多种物质混合而成的物质。
(2)纯净物:由单一物质组成的物质 注:由同位素原子组成的物质是纯净物,如H2O和D2O混合后仍为纯净物。
(3)单质:由同种元素组成的纯净物,可分为金属单质和非金属单质。
(4)化合物:由不同种元素组成的纯净物。从不同角度可见化合物分为离子化合物,共价化合物,电解质和非电解质,有机化合物和物质化合物,酸碱盐和氧化物等。
混合物、纯净物、单质、化合物的概念:
(1)混合物:由两种或多种物质混合而成的物质
混合物没有固定的组成,一般没有固定的熔沸点
常见特殊名称的混合物:氨水、氯水、王水、天然水、硬水、软水、盐酸、浓硫酸、福尔马林、水玻璃、爆鸣气、水煤气、天然气、焦炉气、高炉煤气、石油气、裂解气、空气、合金、过磷酸钙、漂白粉、黑火药、铝热剂、水泥、铁触媒、玻璃、煤、石油、石油的各种馏分
注:由同素异形体组成的物质为混合物,如红磷和白磷。
(2)纯净物:由单一物质组成的物质
注:由同位素原子组成的物质是纯净物,如H2O和D2O混合后仍未纯净物。
(3)单质:由同种元素组成的纯净物,可分为金属单质和非金属单质
(1)金属单质:如Fe、Al、Cu等
(2)非金属单质:如Cl2、O2、S等
(4)化合物:由不同种元素组成的纯净物。从不同角度可见化合物分为离子化合物,共价化合物,电解质和非电解质,有机化合物和物质化合物,酸碱盐和氧化物等。
(5)酸、碱、盐、氧化物
①酸:电离理论认为电解质电离出阳离子全部是H+的化合物
常见的强酸:HClO4 H2SO4 HCl HNO3等
常见的弱酸:H2SO3 H3PO4 HF H2CO3 CH3COOH等
②碱:电离理论认为电解质电离出阴离子全部是OH-的化合物
常见强碱:NaOH KOH Ba(OH)2 Ca(OH)2等
常见弱碱:NH3·H2O Al(OH)3 Fe(OH)3等
③盐:电离时生成金属阳离子(NH4+)和酸根离子的化合物,可分为:正盐、酸式盐、碱式盐、复盐
a正盐:Na2SO4 Na2CO3 (NH4)2SO4 等
b酸式盐:NaHCO3 NaHSO4 NaH2PO4 Na2HPO4等
c碱式盐:Cu(OH)2CO3 Mg(OH)2CO3等
d复盐:KAl(SO4)2·H2O (NH4)2Fe(SO4)2·6H2O等
(6)氧化物:由两种元素组成,其中一种元素是氧的化合物
①按组成分:
金属氧化物:Na2O Al2O3 Fe3O4等
非金属氧化物:NO2 SO2 CO2等
②按性质分:
不成盐氧化物:CO NO等
酸性氧化物:CO2 SO2等
碱性氧化物:Na2O CuO等
两性氧化物:Al2O3 ZnO等
过氧化物:Na2O2 H2O2等
超氧化物:KO2等
特殊例子提醒:
(1)胆矾、明矾等结晶水合物是纯净物,不是物质和水的混合物。
(2)碱性氧化物一定是金属氧化物,但金属氧化物不一定是碱性氧化物(如Mn2O7为酸性氧化物、Al2O3为两性氧化物、Na2O2为过氧化物)。
(3)酸性氧化物不一定是非金属氧化物(如Mn2O7);非金属氧化物也不一定是酸性氧化物(如CO、NO)。
(4)酸性氧化物、碱性氧化物不一定都能与水反应生成相应的酸、碱(如SiO2、CuO)。
(5)与水反应生成酸的氧化物不一定是酸性氧化物(如NO2);与水反应生成碱的氧化物不一定是碱性氧化物(如Na2O2)。
无机物分类:

氧化物的分类:
分子之间通过分子间作用力结合形成的晶体,熔沸点低,导热性、延展性不良,导电性差,硬度较小。如:干冰、固态氖。
晶体的基本类型与性质:

晶体结构模型:
| 晶体 | 晶体结构模型 |
| 氯化铯晶体 |  |
| 氯化钠晶体 | 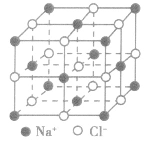 |
| 氟化钙晶体 |  |
| 二氧化碳晶体 | 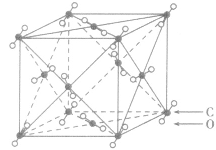 |
| 金刚石晶体 |  |
| SiO2晶体 | 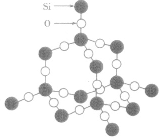 |
| 石墨晶体 (混合晶体) | 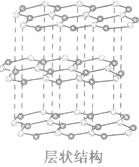 |
晶体中的几个不一定:
(1)由非金属元素构成的晶体不一定为分子品体。如NH4Cl。
(2)具有导电性的晶体不一定是金属晶体。如Si、石墨。
(3)离子晶体不一定只含离子键。如NaOH、 FeS2、Na2O2。
(4)由氢化物构成的晶体不一定是分子晶体。如NaH。
(5)金属与非金属元素构成的晶体不一定是离子晶体。如AlCl3为分子晶体。
(6)原子晶体不一定为绝缘体。如Si。
(7)溶于水能导电的晶体不一定是离子晶体。如HCl。
(8)离子晶体的熔点不一定低于原子晶体。如 MgO的熔点为2852℃,而SiO2的熔点为1710℃。
(9)金属晶体的熔点不一定低于原子晶体。如w 的熔点达34lO℃。
(10)金属晶体的熔点不一定高于分子晶体。如 Hg常温下呈液态,而硫、白磷常温下呈同态.
(11)金属晶体的硬度不一定小于原子晶体。如Cr 的硬度为9,仅次于金刚石。
(12)金属晶体的硬度不一定大于分子晶体。如 Na的硬度只有0.4,可用小刀切割。
(13)晶体巾有阳离子不一定有阴离子。如构成金
与“下列叙述正确的是[ ]A.分子晶体中一定存在分子间作用力B.阳...”考查相似的试题有:
- 纳米材料是当今世界的一种新型材料,广泛地应用于建筑、医学、电子等方面,纳米材料是指( )A.尺度为米粒大小的颗粒制成的...
- 下列物质所属的类别正确的是( )A.醋酸:一元强酸B.液氯:混合物C.Na2O2:碱性氧化物D.NaHSO4:酸式盐
- 现有下列物质:海水、氯酸钾、冰水、熟石灰、NH3、HNO3,苛性钠;其中①属于酸的是_______,②属于碱的是____________,③属于盐...
- 以下8种为中学化学中常见的物质:①NH3﹒H2O ②HCl ③NaOH ④SO3⑤H2SO4⑥C2H5OH ⑦CaCO3⑧BaSO4按下列标准进行分类,请将物质序号填...
- 化工生产中常常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱.(1)从物质的分类角度看,不恰当的一种物质...
- (1)根据交叉分类法,请用斜线将下面框图1的盐与盐的分类连接起来.(2)现有下列物质:A.豆浆B.食盐水C.铁D.硫酸E.氢...
- 以下是依据一定的分类标准,对某些物质与水反应情况进行分类的图示。请根据你所学的知识,按要求填空:(1)上述第一级分类标准...
- 下列说法正确的是A.硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物B.蔗糖、硝酸钾和硫酸钡分别属于非电解质、强电...
- 含元素种类最少的物质是 ( )A.氨水B.氯水C.双氧水D.石灰水
- 在核电荷数1~18的元素中,其单质属于金属晶体的有_______________,属于分子晶体的有_______________,属于原子晶体的有_____...