本试题 “下列实验方案和操作中合理的是( )A.SO42-的检验:加入HNO3酸化的BaCl2溶液,观察是否有白色沉淀生成B.除去NO中混有的少量NO2,可以将混合气体通入水中,...” 主要考查您对一氧化氮
二氧化氮
离子的检验
物质的鉴别
酸碱中和滴定
实验操作达到的预期目的
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 一氧化氮
- 二氧化氮
- 离子的检验
- 物质的鉴别
- 酸碱中和滴定
- 实验操作达到的预期目的
氮元素有+1、+2、+3、+4、+5五种正价,五种正价对应六种氧化物N2O(俗称“笑气”,具有麻醉作用)、 NO、N2O4(暗蓝色气体)、NO2、N2O4、N2O5(白色固体)。其中N2O3和N2O5分别是HNO2和HNO3的酸酐,它们都是空气污染物,空气中的NO2是造成光化学污染的主要因素。另外,在思考某些问题时,要注意:2NO2
 N2O4。对气体体积及平均相对分子质量的影响:
N2O4。对气体体积及平均相对分子质量的影响:一氧化氮的物理性质和化学性质:
(1)物理性质:无色、不溶于水、有毒的气体,密度比空气稍重。
(2)化学性质:
①极易被空气中的O2氧化: 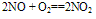
②NO中的氮为+2价,处于中间价态,既有氧化性又有还原性。
二氧化氮的物理性质和化学性质:
(1)物理性质:红棕色、有刺激性气味、有毒的气体,易溶于水、易液化,比空气重。
(2)化学性质:
与H2O反应: 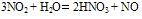
(工业制HNO3原理,在此反应中,NO2同时作氧化剂和还原剂)
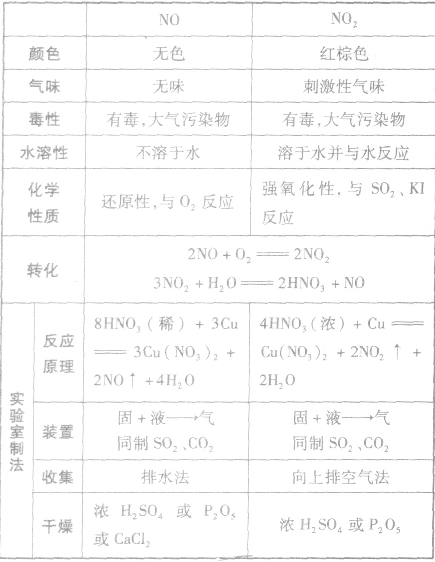
NO、NO2的性质、实验室制法的比较:
隐含反应: 的应用:
的应用:
通常“纯净”的NO2或N2O4并不纯,因为在常温、常压下能发生反应 ,由于此平衡的存在,导致一些物理量的理论值与实验值有一定的误差。例如:
,由于此平衡的存在,导致一些物理量的理论值与实验值有一定的误差。例如:
1.收集到的1mo1NO2在标准状况下的体积应小于22.4L
2.标准状况下22.4LNO2的质量大于46g。
3.NO与O2混合后,所得物质的相对分子质量应大于按体积比求得的数值。
4.温度影响“ ”平衡体系,其他条件不变,体系颜色随温度改变而改变。升高温度,气体颜色变深;降低温度,气体颜色变浅。
”平衡体系,其他条件不变,体系颜色随温度改变而改变。升高温度,气体颜色变深;降低温度,气体颜色变浅。
5.恒容时,在“ ”平衡体系中增加 N01,相当于增大压强。
”平衡体系中增加 N01,相当于增大压强。
有关混合气体NO、NO2、O2溶于水的计算:
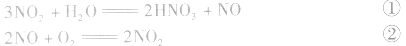
①×2+②得NO2、O2与水反应生成HN3,的化学方程式为: 
①×2+②×3得NO、O2与水反应生成HNO3的化学方程式为: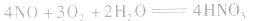
一般NO、NO2、O2与水反应,可归纳成四种情况:
1.NO和NO2混合 剩余气体为NO
剩余气体为NO
2.NO2和O2混合
3.NO和O2混合 
4.NO2、NO、O2的混合
当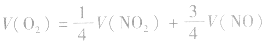 时,反应后无气体剩余
时,反应后无气体剩余
特例:当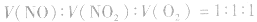 时,无气体剩余。
时,无气体剩余。
(1)焰色反应:Na+:黄色;K+:紫色(透过蓝色钴玻璃观察);Ca2+:砖红色;
(2)H+:H+酸性。遇紫色石蕊试液变红,遇湿润蓝色石蕊试纸变红;
(3)NH4+:在试液中加强碱(NaOH)加热,产生使湿润红色石蕊试纸变蓝的气体;NH4++OH-
 NH3↑+H2O;NH3+H2O
NH3↑+H2O;NH3+H2O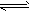 NH3?H2O
NH3?H2O NH4++OH-
NH4++OH- (4)Fe3+:①通KSCN或NH4SCN溶液呈血红色:Fe3++SCN-==[Fe(SCN)]2+;②通NaOH溶液红褐色沉淀:Fe3++3OH-==
Fe(OH)3↓
(5)Fe2+:①遇NaOH溶液生成白色沉淀在空气中迅速转化成灰绿色最后变成红褐色沉淀:Fe3++2OH-=Fe(OH)2↓;
4Fe(OH)2+O2+2H2O==4Fe(OH)3;
②试液中加KSCN少量无明显变化再加氯水出现血红色: 2Fe2++Cl2==2Fe3++2Cl-;Fe3++SCN-==[Fe(SCN)]2+
(6)Mg2+:遇NaOH溶液有白色沉淀生成,NaOH过量沉淀不溶解:Mg2++2OH-==Mg(OH)2↓,但该沉淀能溶于NH4Cl溶液;
(7)Al3+:遇NaOH溶液(适量)有白色沉淀生成,NaOH溶液过量沉淀溶解:Al3++3OH-==Al(OH)3↓;Al(OH)3+OH-==
AlO2-+2H2O
(8)Cu2+:遇NaOH溶液有蓝色沉淀生成,加强热变黑色沉淀:Cu2++2OH-==Cu(OH)2↓;Cu(OH)2
 CuO+H2O
CuO+H2O (9)Ba2+:遇稀H2SO4或硫酸盐溶液有白色沉淀生成,加稀HNO3沉淀不溶解:Ba2++SO42-==BaSO4↓
(10)Ag+: ①加NaOH溶液生成白色沉淀,此沉淀迅速转变为棕色沉淀溶于氨水Ag++OH-==AgOH↓;2AgOH==Ag2O+H2O;AgOH+2NH3?H2O==[Ag(NO3)2]OH+2H2O
②加稀HCl或可溶性氧化物溶液再加稀HNO3生成白色沉淀:Ag++Cl-==AgCl↓
(11)OH-:OH-碱性:①遇紫色石蕊试液变蓝;②遇酚酞试液变红;③遇湿润红色石蕊试纸变蓝;
(12)Cl-:遇AgNO3溶液有白色沉淀生成,加稀HNO3沉淀不溶解:Ag++Cl-=AgCl↓
(13)Br-:加AgNO3溶液有浅黄色沉淀生成,加稀HNO3沉淀不溶解:Ag++Br-=AgBr↓
(14)I-: ①加AgNO3溶液有黄色沉淀生成,加稀HNO3沉淀不溶解:Ag++I-=AgI↓;②加少量新制氯水后再加淀粉溶液显蓝色:2I-+Cl2=I2+2Cl-;I2遇淀粉变蓝
(15)S2-:①加强酸(非强氧化性)生成无色臭鸡蛋气味气体:S2-+2H+=H2S↑;②遇Pb(NO3)2或(CH3COO)2Pb试液生成黑色沉淀,遇CuSO4试液产生黑色沉淀:Pb2++S2-=PbS↓;Cu2++S2-=CuS↓
(16)SO42-:加可溶性钡盐[BaCl2或Ba(NO3)2]溶液有白色沉淀生成后再加稀HCl或稀HNO3沉淀不溶解:Ba2++SO42-=BaSO4↓
(17)SO32-:加强酸(H2SO4或HCl)把产生气体通入品红溶液中,品红溶液褪色:SO32-+2H+=H2O+SO2↑ SO2使品红溶液褪色
(18)CO32-:加稀HCl产生气体通入澄清石灰水,石灰水变浑浊:CO32-+2H+=H2O+CO2↑;CO2+Ca(OH)2=CaCO3↓+H2O
(19)HCO3-:取含HCO3-盐溶液煮沸,放出无色无味、使澄清石灰水变浑浊的气体;或向HCO3-溶液里加入稀MgSO4溶液,无现象,加热煮沸有白色沉淀MgCO3生成,同时放出CO2气体。
(20)NO3-:浓缩试液加稀硫酸和铜片加热有红棕色气体产生,溶液变成蓝色:
Cu+4H++2NO3-=Cu2++2NO2↑+2H2O
(21)PO43-:加AgNO3溶液产生黄色沉淀,再加稀HNO3沉淀溶解:3Ag++PO43-=Ag3PO4↓;Ag3PO4溶于稀HNO3酸。
根据几种不同物质的性质不同及实验现象不同,将其一一区别开。
鉴别是根据化合物的不同性质来确定其含有什么官能团,是哪种化合物。如鉴别一组化合物,就是分别确定各是哪种化合物即可。在做鉴别题时要注意,并不是化合物的所有化学性质都可以用于鉴别,必须具备一定的条件:
(1)化学反应中有颜色变化
(2)化学反应过程中伴随着明显的温度变化(放热或吸热)
(3)反应产物有气体产生
(4)反应产物有沉淀生成或反应过程中沉淀溶解、产物分层等。
互滴现象不同的化学反应:
1.Na2CO3与稀盐酸的反应
(1)向稀盐酸中滴加Na2CO3溶液,立即有气泡产生。
(2)向Na2CO3溶液中滴加稀盐酸,边滴加边振荡,开始不产生气泡,后来产生气泡。
2.Ca(OH)2溶液与H3PO4溶液的反应
(1)向H3PO4溶液中滴加Ca(OH)2溶液,开始不产生白色沉淀,后来产生白色沉淀。
(2)向Ca(OH)2溶液中滴加H3PO4溶液,肝始有白色沉淀,后来白色沉淀逐渐消失。
3.NaOH溶液与AlCl3溶液的反应
(1)向AlCl3溶液中滴加NaOH溶液,开始产生白色沉淀,后来白色沉淀逐渐消失j
(2)向NaOH溶液中滴加AlCl3溶液,开始不产生白色沉淀,后来产生白色沉淀。
4.NaAlO2溶液与稀盐酸反应
(1)向NaAlO2溶液中滴加稀盐酸,开始有白色沉淀产生,后来白色沉淀逐渐消失。
(2)向稀盐酸中滴加NaAlO2溶液,开始不产生白色沉淀,后来产生白色沉淀。
5.AgNO3溶液与NH3·H2O反应
(1)向NH3·H2O中滴加AgNO3溶液,开始不产生沉淀 
(2)向AgNO3溶液中滴加NH3·H2O,开始出现沉淀,最终沉淀消失。
有机化合物的鉴别方法:
(1)烯烃、二烯、炔烃:
①溴的四氯化碳溶液,红色腿去
②高锰酸钾溶液,紫色腿去。
(2)含有炔氢的炔烃:
①硝酸银,生成炔化银白色沉淀
②氯化亚铜的氨溶液,生成炔化亚铜红色沉淀。
(3)小环烃:三、四元脂环烃可使溴的四氯化碳溶液腿色
(4)卤代烃:硝酸银的醇溶液,生成卤化银沉淀;不同结构的卤代烃生成沉淀的速度不同,叔卤代烃和烯丙式卤代烃最快,仲卤代烃次之,伯卤代烃需加热才出现沉淀。
(5)醇:
①与金属钠反应放出氢气(鉴别6个碳原子以下的醇);
②用卢卡斯试剂鉴别伯、仲、叔醇,叔醇立刻变浑浊,仲醇放置后变浑浊,伯醇放置后也无变化。
(6)酚或烯醇类化合物:
①用三氯化铁溶液产生颜色(苯酚产生兰紫色)。
②苯酚与溴水生成三溴苯酚白色沉淀。
(7)羰基化合物:
①鉴别所有的醛酮:2,4-二硝基苯肼,产生黄色或橙红色沉淀;
②区别醛与酮用托伦试剂,醛能生成银镜,而酮不能;
③区别芳香醛与脂肪醛或酮与脂肪醛,用斐林试剂,脂肪醛生成砖红色沉淀,而酮和芳香醛不能;
④鉴别甲基酮和具有结构的醇,用碘的氢氧化钠溶液,生成黄色的碘仿沉淀。
(8)甲酸:用托伦试剂,甲酸能生成银镜,而其他酸不能。
(9)胺:区别伯、仲、叔胺有两种方法
①用苯磺酰氯或对甲苯磺酰氯,在NaOH溶液中反应,伯胺生成的产物溶于NaOH;仲胺生成的产物不溶于NaOH溶液;叔胺不发生反应。
②用NaNO2+HCl:脂肪胺:伯胺放出氮气,仲胺生成黄色油状物,叔胺不反应。芳香胺:伯胺生成重氮盐,仲胺生成黄色油状物,叔胺生成绿色固体。
(10)糖:
①单糖都能与托伦试剂和斐林试剂作用,产生银镜或砖红色沉淀;
②葡萄糖与果糖:用溴水可区别葡萄糖与果糖,葡萄糖能使溴水褪色,而果糖不能。
③麦芽糖与蔗糖:用托伦试剂或斐林试剂,麦芽糖可生成银镜或砖红色沉淀,而蔗糖不能。
(11)使溴水褪色的有机物有:
①不饱和烃(烯、炔、二烯、苯乙烯等);
②不饱和烃的衍生物(烯醇、烯醛等);
③石油产品(裂化气、裂解气、裂化石油等);
④天然橡胶;
⑤苯酚(生成白色沉淀)。
(12)因萃取使溴水褪色的物质有:
①密度大于1的溶剂(四氯化碳、氯仿、溴苯、二硫化碳等);
②密度小于1的溶剂(液态的饱和烃、直馏汽油、苯及其同系物、液态环烷烃、液态饱和酯)。
(13)使酸性高锰酸钾溶液褪色的有机物有:
①不饱和烃;②苯的同系物;③不饱和烃的衍生物;④部分醇类有机物;⑤含醛基的有机物:醛、甲酸、甲酸酯、甲酸盐;⑥石油产品(裂解气、裂化气、裂化石油);⑦天然橡胶。
酸碱中和滴定:
用已知物质的量浓度的酸(或碱)来测 定未知物质的量浓度的碱(或酸)的方法叫做酸碱中和滴定。
(1)原理:对于一元酸和一元碱发生的中和反应,C酸V酸=C碱V碱 或:C未知V未知=C标准V标准,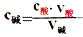
(2)仪器:a.酸式滴定管 b.碱式滴定管c.铁架台d.滴定管夹e.锥形瓶 f.烧杯g.胶头滴管等
(3)装置图: 
(4)操作步骤:
洗涤、检漏、水洗、润洗、装液、去泡、调液面记录、放待测液、加指示剂、滴定、记录、
计算、误差分析
(5)数据处理依据:
c(NaOH)=c(HCl)V(HCl)/V(NaOH)
(6)误差分析:
①仪器润洗不当:
a.盛标准液的滴定管用蒸馏水洗后未用标准液润洗;
b.盛待测液滴定(移液)管用蒸馏水洗后未用待测液润洗;
c.锥形瓶用蒸馏水洗后再用待测液润洗;
②读数方法有误:
a.滴定前仰视,滴定后俯视;
b.滴定前俯视,滴定后仰视;
c.天平或量筒的使用读数方法错误;
③操作出现问题:
a.盛标准液的滴定管漏液;
b.盛待测液的滴定管滴前尖嘴部分有气泡,终了无气泡
(或前无后有);
c.振荡锥形瓶时,不小心有待测液溅出;
d.滴定过程中,将标准液滴到锥形瓶外;
中和滴定中的误差分析:
中和滴定是一个要求较高的定量实验,每一个不当的或错误的操作都会引起误差。
对于一元酸与一元碱,由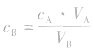 可知,
可知,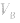 是准 确量取的体积,
是准 确量取的体积, 是标准溶液的浓度,它们均为定值,所以
是标准溶液的浓度,它们均为定值,所以 的大小取决于
的大小取决于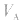 的大小,
的大小,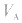 大则
大则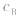 大,
大,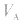 小则
小则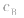 小。
小。
以标准酸溶液滴定末知浓度的碱溶液(酚酞作指示剂)为例,常见的不正确操作对实验结果的影响见下表: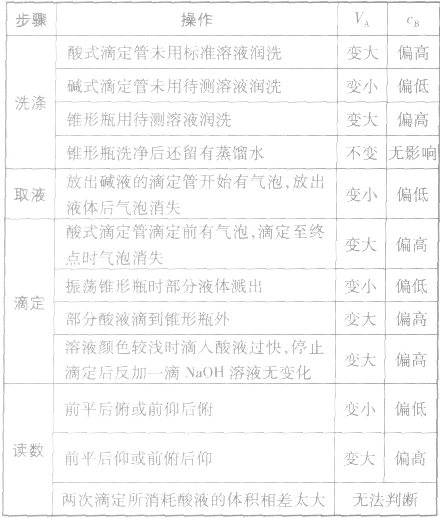
中和滴定应注意的问题:
1.中和滴定中指示剂的使用与选择
(1)用量不能太多,常用2~3滴,冈指示剂本身也是有机弱酸或有机弱碱,若用量太多,会使中和滴定中需要的酸或碱的量增多或减少。
(2)指示剂的选择:中和滴定时一般选用的指示剂有酚酞和甲基橙。石蕊试液由于颜色变化不明显,不易辨别,在滴定过程中不宜使用。
(3)酸、碱恰好完全反应时,终点溶液的pH应在指示剂的变色范围内,如强酸溶液滴定弱碱溶液应选用甲基橙作指示剂;强碱溶液滴定弱酸溶液应选用酚酞作指示剂。
(4)指示剂的变色:最好由浅到深,这样对比明显。如用强碱滴定强酸用酚酞作指示剂较好,当酚酞从无色变为粉红色(或浅红色)且半分钟内不褪色时即达到滴定终点。
2.欲减小实验误差的三点做法
(1)半分钟:振荡,半分钟内颜色不褪去,即为滴定终点。
(2)l一2min:滴定停止后,必须等待l~2min,让附着在滴定管内壁的溶液流下后,再进行读数。
(3)重复:同一实验,要做两到三次,两次滴定所用标准溶液的体积的差值不能超过0.02mL,再取平均值。
(1)①用托盘天平称取5.6g氧化铜粉末(托盘天平能准确到0.1克,所以用托盘天平称取5.6g氧化铜粉末是可以的)
②用10mL水和10mL酒精配制成20mL酒精溶液(由于分子间有间隔,10mL水和10mL静静混合后体积,不能配制成20mL酒精溶液)
③用排水集气法可收集到比较纯净的氧气(收集到的气体要比排空气法收集到的气体纯,由于空气的密度与氧气的密度相差不是很大,所以排空气法收集到的气体氧气不是很纯)
④用10mL量筒量取8.2mL水(10mL量筒精确到0.1mL,所以能量取8.2mL水)
(2) ①分别加入饱和碳酸钠溶液,鉴别乙酸乙酯和乙酸(观察到有气泡产生的是乙酸,能到到鉴别的目的)
②分别加入少量金属钠,比较水和乙醇中羟基氢的活泼性(通过观察与金属钠反应的剧烈程度可以判断羟基的活泼性,能达到目的)
③分别加入浓硝酸,比较铁和铜的金属活动性(铁和铜都能和浓硝酸反应,不能达到比较金属活动性的目的)
与“下列实验方案和操作中合理的是( )A.SO42-的检验:加入HNO3...”考查相似的试题有:
- 下列有关物质的性质或用途的叙述中,正确的是( )A.常温下,运输浓硫酸、浓硝酸时可用铝制或铁制槽车B.钠很软,可用手掰开...
- 乙醇汽油是一种由粮食及各种植物纤维加工成的燃料乙醇,和普通汽油按一定比例混配形成的新型替代能源。有人指出,近年来冬季...
- 下列除去杂质的实验方法不正确的是 ( )A.除去CO2中少量HCl气体:通过饱和NaHCO3溶液后再干燥气体B.除去Na2CO3固体中少量N...
- 不能鉴别、、和四种溶液(不考虑他们间的相互反应)的试剂是A.盐酸、硫酸B.盐酸、氢氧化钠溶液C.氨水、硫酸D.氨水、氢氧...
- 下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题(1)写出由④、⑤、⑧元素中形成的既含离子键又含共价键的...
- 下列各组液体混合物中,能用分液漏斗分离的是A.淀粉溶液和食盐溶液B.CCl4和水C.乙酸和乙酸乙酯D.乙酸和乙醇
- 下列各组物质用括号内试剂加以鉴别,其中不合理的是A.Na2CO3溶液和Na2SO4溶液(稀盐酸)B.CO2和H2(澄清石灰水)C.NH4Cl溶...
- 能用于区别两种棕黄色的液体FeCl3溶液和溴水的试剂是( )A.Fe粉B.KSCNC.H2OD.淀粉KI溶液
- 在酸碱中和滴定实验中,由于下列操作错误,会引起待测NaOH溶液浓度值偏低的是( )A.所用酸式滴定管尖端部分有气泡,滴定后...
- 下列有关实验的说法正确的是( )A.现向K2Cr2O7溶液中加入少量氢氧化钠,溶液变为黄色,证明溶液中存在着平衡:Cr2O72-+H2O⇌...