本试题 “常温下,向0.1mol•L-1的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验时...” 主要考查您对离子方程式
离子反应
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 离子方程式
- 离子反应
用实际参加反应的离子符号表示离子反应的式子。
离子方程式书写规则:
①写:写出化学反应方程式
②拆:把易溶于水、易电离的物质写成离子形式,难容难电离的物质及气体等仍用化学式表示
③删:删去方程式两边不参加反应的离子
④查:检查离子方程式两边各元素的原子个数和电荷总数是否相等
离子方程式书写及正误的判断方法:
①判断反应是否在水溶液中进行
因为电解质在水溶液中可以电离为自由移动的离子,在这种条件下才能发生离子反应。
②判断反应能否发生。
如果反应不能发生,当然也就没有离子方程式可言。
③判断反应物、生成物是否正确。
④判断质量和电荷是否守恒。
离子方程式不仅要质量守恒,而且反应前后各离子所带电荷总数必须相等。
⑤判断氧化物、难溶物、气体、单质、难电离的弱酸、弱碱、水是否写成了分子形式,而易电离的物质是否写成离子形式。
⑥判断连接符号“=”和“
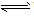 ”及状态符号“↑”和“↓”运用是否正确。
”及状态符号“↑”和“↓”运用是否正确。 强电解质的电离、不可逆反应、双水解反应用“=”;弱电解质电离、可逆反应、水解反应用“
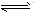 ”。复分解反应、水解反应生成的难溶物用“↓”,气体用“↑”;单水解反应生成的难溶物不用“↓”,气体不用“↑”。
”。复分解反应、水解反应生成的难溶物用“↓”,气体用“↑”;单水解反应生成的难溶物不用“↓”,气体不用“↑”。 ⑦判断微溶物的处理是否正确。
微溶物做反应物时,一般用离子形式,做生成物时一般用分子式。
⑧判断反应物的滴加顺序与方程式中生成物是否一致。
如:把碳酸钠溶液滴加到盐酸溶液中,和把盐酸滴加到碳酸钠溶液中反应产物是不同的。
⑨判断反应物的相对量与产物是否一致。
有些反应因反应物的量不同会生成不同的产物。如:CO2、SO2、H2S等气体与碱溶液反应时,若气体少量,则生成正盐;若气体过量,则生成酸式盐。
⑩判断电解质在写成离子形式时阴阳离子个数比是否合理。
如Ba(OH)2溶液和稀H2SO4反应的离子方程式往往错误写成:
 ,正确为:
,正确为: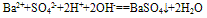
书写与量有关的离子方程式:
基本方法是:把物质的量少的物质的系数定为1,其他物质按最大量消耗。
1.因滴加顺序不同造成连续反应
- HCl与Na2CO3
向Na2CO3溶液中滴入盐酸溶液至过量,其离子反应分步写 (1)CO32-+H+==HCO3- (2)HCO3-+H+==CO2↑+H2O
若向盐酸溶液中滴入Na2CO3溶液至不再产生气体,其离子反应一步完成 CO32-+2H+==CO2↑+H2O
若向足量Na2CO3溶液中加入少量的盐酸溶液,其离子方程式为: CO32-+H+==HCO3-
- HCl与NaAlO2
向Na2CO3溶液中滴入盐酸溶液至过量,其离子反应分步写 (1)CO32-+H+==HCO3- (2)HCO3-+H+==CO2↑+H2O
若向盐酸溶液中滴入Na2CO3溶液至不再产生气体,其离子反应一步完成 CO32-+2H+==CO2↑+H2O
若向足量Na2CO3溶液中加入少量的盐酸溶液,其离子方程式为: CO32-+H+==HCO3-
- AlCl3与NaOH
向AlCl3溶液中滴入NaOH溶液至过量,其离子反应分步写 (1)Al3++3OH-==Al(OH)3↓ (2)Al(OH)3+OH-==AlO2-+2H2O
若向NaOH溶液中加入少量AlCl3溶液,其离子反应一步完成 Al3++4OH-==AlO2-+2H2O
若向足量Al2(SO4)3溶液中加入少量的NaOH溶液,其离子方程式为: Al3++3OH-==Al(OH)3↓
- AgNO3与NH3·H2O
向AgNO3溶液中滴入稀NH3·H2O至过量,其离子反应分步写(1) Ag++NH3·H2O==AgOH↓+NH4+ (2)AgOH+2NH3·H2O==Ag(NH3)2++OH-+2H2O
若向NH3·H2O溶液中加入少量AgNO3,其离子反应一步完成 Ag++3NH3·H2O==Ag(NH3)2++OH-+NH4++2H2O
若向足量AgNO3溶液中滴入少量NH3·H2O,其离子方程式为:Ag++NH3·H2O==AgOH↓+NH4+
- CO2与NaOH
向NaOH溶液中通人CO2气体至过量,其离子反应分步写 (1)2OH-+CO2==CO32-+H2O (2)CO32-+CO2+H2O==2HCO3-
若向足量NaOH溶液中通人少量CO2气体,其离子方程式为: 2OH-+CO2==CO32-+H2O
若向NaOH溶液中通人过量CO2气体,其离子反应一步完成 OH-+CO2==HCO3-
2.过量型:
向足量的Ca(HCO3)2溶液中逐渐滴入NaOH溶液 OH-+Ca2++HCO3-==H2O+CaCO3↓
向足量的NaOH溶液中逐渐滴入Ca(HCO3)2溶液 Ca2++2HCO3-+2OH-==2H2O+CaCO3↓+CO32-
Fe与HNO3 :铁过量时:Fe+4HNO3==Fe(NO3)3+NO↑+2H2O
铁不足时:3Fe+8HNO3==3Fe(NO3)2+2NO↑+4H2O
3.定量型:
因还原性I->Fe2+>Br-,所以在FeI2或者FeBr2中通入一定量的Cl2,发生不同的离子反应,依次为:
(1)2I-+Cl2==2Cl-+I2(2)2Fe2++Cl2==2Fe3++2Cl-(3)2Br-+Cl2==2Cl-+Br2
4.目标型
向明矾溶液逐滴滴加Ba(OH)2溶液至硫酸根离子刚好沉淀完全 Al3++SO42-+Ba2++4OH-==AlO2-+2BaSO4↓+2H2O
向明矾溶液逐滴滴加Ba(OH)2溶液至铝离子刚好沉淀完全 Al3+SO42-+Ba2++3OH-==Al(OH)3↓+2BaSO4↓
凡是有离子参加或离子生成的反应都是离子反应。
离子反应包括:复分解反应、氧化还原反应、络合反应、双水解反应
常见阳离子的检验方法:
| 离子 | 检验试剂 | 实验步骤 | 实验现象 | 离子方程式 |
| K+ | 焰色反应 | ①铂丝在火焰上灼烧至原火焰色②蘸取溶液,放在火焰上灼烧,观察火焰颜色。 | 浅紫色(通过蓝色钴玻璃片观察钾离子焰色) | —— |
| Na+ | 焰色反应 | 火焰分别呈黄色 | ||
| NH4+ | NaOH溶液(浓) | 向未知溶液中加入NaOH浓溶液并加热 | 生成有刺激性气味、使湿润红色石蕊试纸变蓝的气体 | NH4++OH-=NH3↑+H2O |
| Al3+ | 加NaOH溶液 | 向未知溶液中加入NaOH溶液 | 加入适量NaOH溶液后生成白色沉淀,该沉淀溶于过量NaOH溶液中 |
Al3++3OH-=Al(OH)3↓ |
| Cu2+ | 浓氨水 | 向未知溶液中加入浓氨水 | 加入适量浓氨水后生成蓝色沉淀,该沉淀溶于过量浓氨水中,溶液呈深蓝色 |
Cu2++2OH-=Cu(OH)2↓ Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O |
| Ag+ | ①稀盐酸或可溶性盐酸盐②稀HNO3③氨水 | 向未知溶液中加入稀盐酸再加入稀HNO3向过滤出的沉淀中加氨水 | 生成白色沉淀,不溶于稀HNO3,但溶于氨水,生成[Ag(NH3)2]+ | Ag++Cl-=AgCl↓ |
| Ba2+ | 稀H2SO4或可溶性酸盐溶液 | 向未知溶液中加入稀H2SO4再加入稀HNO3 | 产生白色沉淀,且沉淀不溶于稀HNO3 | Ba2++SO42-=BaSO4↓ |
| Fe3+ | KSCN溶液 | 向未知溶液中加入KSCN溶液或加NaOH溶液或加苯酚 | 变为血红色溶液 | Fe3++3SCN-=Fe(SCN)3 |
| 加NaOH溶液 | 产生红褐色沉淀 | Fe3++3OH-=Fe(OH)3↓ | ||
| 加苯酚 | 溶液显紫色 | Fe3++6C6H6OH→[Fe(C6H5O)]3-+6H+ | ||
| Fe2+ | ①加NaOH溶液 | 向未知溶液中加入NaOH溶液并露置在空气中 | 开始时生成白色Fe(OH)2沉淀,迅速变成灰绿色,最后变成红褐色Fe(OH)3沉淀。 | Fe2++2OH-=Fe(OH)2↓ 4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
| ②KMnO4 (H+)溶液 | 向未知溶液中加入KMnO4(H+)溶液 | KMnO4(H+)紫色褪去 | MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O | |
| ③K3[Fe(CN)6] | 向未知溶液中加入K3[Fe(CN)6]溶液 | 出现蓝色Fe3[Fe(CN)6]2沉淀 | 3Fe2++2[Fe(CN)6]-=Fe3[Fe(CN)6]2↓ | |
| ④KSCN溶液,新制的氯水 | 加入KSCN溶液,新制的氯水 | 加入KSCN溶液不显红色,加入少量新制的氯水后,立即显红色。 | 2Fe2++Cl2=2Fe3++2Cl-Fe3++3SCN-=Fe(SCN)3 |
常见阴离子的检验方法:
| 离子 | 检验试剂 | 实验步骤 | 实验现象 | 离子方程式 |
| CO32- | ①BaCl2溶液、稀盐酸 | 向未知溶液中加入BaCl2溶液再向沉淀中加入稀盐酸 | 加入BaCl2溶液后生成白色沉淀,沉淀溶于稀盐酸,并放出无色无味气体 | Ba2++CO32-=BaCO3↓ BaCO3+2H+=Ba2++CO2↑+H2O |
| ②稀盐酸、Ca(OH)2溶液 | 加入稀盐酸后放出的气体通入使澄清的Ca(OH)2溶液 | 加入稀盐酸后放出无色无味气体,通入澄清的Ca(OH)2溶液变浑浊 | CO32-+2H+=H2O+CO2↑ Ca2++2OH-+CO2=CaCO3↓+H2O | |
| SO42- | BaCl2溶液、稀硝酸或稀盐酸 | 向未知溶液中加入BaCl2溶液再向沉淀中加入稀盐酸 | 生成不溶于稀硝酸或稀盐酸的白色沉淀 | Ba2++SO42-=BaSO4↓ |
| SO32- | ①BaCl2溶液、稀盐酸 | 向未知溶液中加入BaCl2溶液再向沉淀中加入稀盐酸 | 加入BaCl2溶液后生成白色沉淀,沉淀溶于稀盐酸,并放出刺激性气味的气体 | SO32-+2H+=H2O+SO2↑ |
| ②稀盐酸、品红溶液 | 加入稀盐酸后放出的气体通入品红溶液 | 加入稀盐酸后放出的气体使品红溶液褪色 | SO32-+2H+=H2O+SO2↑ | |
| Cl- | AgNO3溶液、稀硝酸或稀盐酸 | 向未知溶液中加入AgNO3溶液,再向沉淀中加入稀盐酸 | 生成不溶于稀硝酸或稀盐酸的白色沉淀 | Ag++Cl-=AgCl↓ |
| Br- | AgNO3溶液、稀硝酸或稀盐酸 | 生成不溶于稀硝酸或稀盐酸的浅黄色沉淀 | Ag++Br-=AgBr↓ | |
| I- | AgNO3溶液、稀硝酸或稀盐酸 | 向未知溶液中加入AgNO3溶液,再向沉淀中加入稀盐酸 | 生成不溶于稀硝酸的黄色沉淀 | Ag++I-=AgI↓ |
| ②新制氯水,淀粉溶液 | 向未知溶液中加入新制氯水,再加入淀粉溶液 | 滴入新制Cl2,振荡后再滴入淀粉溶液,变蓝 | Ag++I-=AgI↓ 2I-+Cl2=I2+2Cl- I2遇淀粉变蓝 |
2.检验SO32-的试剂中,只能用盐酸,不能用稀硝酸。因为稀硝酸能把SO32-氧化成SO42-。
3.若Ag+和Ba2+同时检验,也需注意检验顺序,应先用盐酸将Ag+检验出并滤去沉淀,然后再用稀硫酸检验Ba2+。
与“常温下,向0.1mol•L-1的硫酸溶液中逐滴加入物质的量浓度相同...”考查相似的试题有:
- 下列离子方程式书写正确的是( )A.淀粉碘化钾试纸上滴稀硝酸变蓝:2I-+4H++NO3-=I2+NO↑+2H2OB.用醋酸除去水垢:CaCO3+2H+=...
- 下列离子方程式正确的是A.NH4C1溶液与NaOH溶液混合混和: OH-+NH4++CI-=NH3·H2O+Cl-B.稀硫酸滴在铜片上: Cu+2H+=Cu2++H2↑C...
- 下列离子方程式书写正确的是( )A.铝粉投入氢氧化钠溶液中:2Al+2OH-═2AlO2-+H2↑B.氯化铝溶液中加入足量的氨水:Al3++3NH3...
- 下列反应的离子方程式正确的是A.稀硫酸与铁反应:2Fe+6H+=2Fe3++3H2↑B.2 mol·L-1的AlCl3溶液和7 mol·L-1的NaOH溶液等...
- 下列离子方程式书写正确的是( )A.铝粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+H2↑B.AlCl3溶液中加入足量的氨水:Al3++3OH-═Al...
- 下列离子方程式正确的是( )A.醋酸溶液中滴入少量氢氧化钠溶液:H++OH-=H2OB.在小苏打溶液中滴入少量的氢氧化钡溶液:2HCO...
- 下列反应的离子方程式正确的是( )A.用小苏打治疗胃酸过多:CO32-+H+=CO2↑+H2OB.实验室用氯化铵与氢氧化钙固体共热制取氨...
- 能用H++OH-=H2O来表示的化学反应是( )A.氢氧化镁和稀硫酸反应B.澄清石灰水和稀硝酸反应C.氢氧化钾溶液滴入稀硫酸中D.二...
- 下列各组物质的稀溶液相互反应,无论是前者滴入后者还是后者滴入前者,反应现象相同的是A.AlCl3和NaOHB.硫酸铝和浓氨水C.N...
- (8分)有一包固体混合物,可能含有的阴、阳离子分别是:阳离子K+、Ba2+、Ag+阴离子SO42-、CO32-、AlO2-、SO32- 为了鉴定其中...