本试题 “下面是元素周期表的简略框架图。回答下列问题:(1)元素a在元素周期表中的位置是_______________,元素i的原子核外最外层电子数为________,元素f和h形成化...” 主要考查您对碳酸氢钠
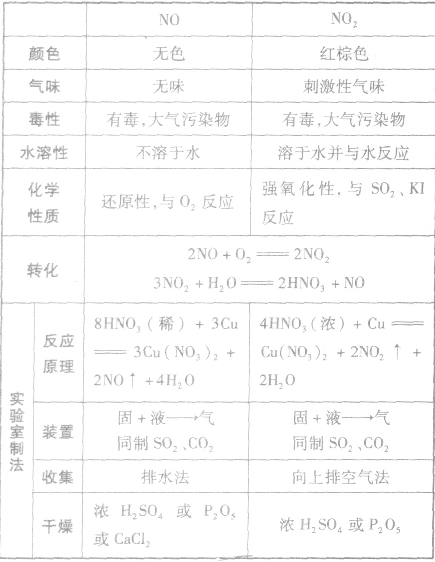
二氧化氮
元素的性质
元素周期表
电子式的书写
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 碳酸氢钠
- 二氧化氮
- 元素的性质
- 元素周期表
- 电子式的书写
碳酸氢钠(NaHCO3):
(1)俗名:小苏打;细小白色晶体,溶解度小于Na2CO3,受热易分解,可用于治疗胃酸过多、发酵剂
(2)与H+反应:HCO3-+H+==CO2↑+H2O
(3)与NaOH反应:HCO3-+OH-==CO32-+H2O
(4)与石灰水反应:生成CaCO3沉淀
(5)与BaCl2和CO2不反应
碳酸氢钠的物理性质:
碳酸氢钠为白色晶体,或不透明单斜晶系细微结晶。比重2.15g。无臭、味咸,可溶于水,不溶于乙醇。其水溶液因水解而呈微碱性,常温中性质稳定,受热易分解,在50℃以上迅速分解,在270℃时完全失去二氧化碳,在干燥空气中无变化,在潮湿空气中缓慢分解。溶解度:7.8g,18℃;16.0g,60℃。
碳酸氢钠的用途:
碳酸氢钠可直接作为制药工业的原料,用于治疗胃酸过多。
Na2CO3、NaHCO3的性质比较:
| 表示 | 名称 | 碳酸钠 | 碳酸氢钠 |
| 化学式 | Na2CO3 | NaHCO3 | |
| 俗称 | 苏打 | 小苏打 | |
| 物理性质 | 色态 | 白色粉末 | 白色晶体 |
| 溶解性 | 易溶于水 | 能溶于水 | |
| 化学性质 | 与盐酸反应 | Na2CO3+2HCl=2NaCl+H2O+CO2↑ | NaHCO3+HCl=NaCl+H2O+CO2↑ |
| 热稳定性 | 很稳定 | 受热分解:2NaHCO3=(加热)=Na2CO3+H2O+CO2↑ | |
| 与NaOH反应 | 不反应 | NaHCO3+NaOH=Na2CO3+H2O | |
| 相互转化 | Na2CO3+H2O+CO2=2NaHCO3 | NaHCO3+NaOH=Na2CO3+H2O 2NaHCO3=(加热)=Na2CO3+H2O+CO2↑ |
Na2CO3、NaHCO3的鉴别:

Na2CO3、NaHCO3与足量盐酸反应的比较:
碳酸钠、碳酸氢钠与盐酸反应的基本图像的归纳总结:
(1)向Na2CO3中逐滴加入盐酸,消耗HCl的体积与产生CO2的体积的关系如图1所示;
(2)向NaHCO3中逐滴加入盐酸,消耗HCl的体积与产生CO2的体积的关系如图2所示;
(3)向NaOH、Na2CO3的混合物中逐滴加入盐酸,消耗HCl的体积与产生CO2的体积的关系如图3所示(设NaOH、Na2CO3的物质的量之比x∶y=1∶1,其他比例时的图像略);
(4)向Na2CO3、NaHCO3的混合物中逐滴加入盐酸,消耗HCl的体积与产生CO2的体积的关系如图4所示(设Na2CO3、NaHCO3的物质的量之比m∶n=1∶1,其他比例时的图像略)。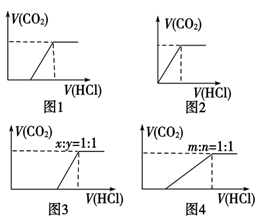
二氧化氮的物理性质和化学性质:
(1)物理性质:红棕色、有刺激性气味、有毒的气体,易溶于水、易液化,比空气重。
(2)化学性质:
与H2O反应: 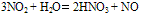
(工业制HNO3原理,在此反应中,NO2同时作氧化剂和还原剂)
NO、NO2的性质、实验室制法的比较:
隐含反应: 的应用:
的应用:
通常“纯净”的NO2或N2O4并不纯,因为在常温、常压下能发生反应 ,由于此平衡的存在,导致一些物理量的理论值与实验值有一定的误差。例如:
,由于此平衡的存在,导致一些物理量的理论值与实验值有一定的误差。例如:
1.收集到的1mo1NO2在标准状况下的体积应小于22.4L
2.标准状况下22.4LNO2的质量大于46g。
3.NO与O2混合后,所得物质的相对分子质量应大于按体积比求得的数值。
4.温度影响“ ”平衡体系,其他条件不变,体系颜色随温度改变而改变。升高温度,气体颜色变深;降低温度,气体颜色变浅。
”平衡体系,其他条件不变,体系颜色随温度改变而改变。升高温度,气体颜色变深;降低温度,气体颜色变浅。
5.恒容时,在“ ”平衡体系中增加 N01,相当于增大压强。
”平衡体系中增加 N01,相当于增大压强。
有关混合气体NO、NO2、O2溶于水的计算:
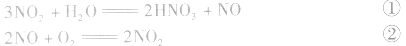
①×2+②得NO2、O2与水反应生成HN3,的化学方程式为: 
①×2+②×3得NO、O2与水反应生成HNO3的化学方程式为: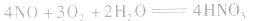
一般NO、NO2、O2与水反应,可归纳成四种情况:
1.NO和NO2混合 剩余气体为NO
剩余气体为NO
2.NO2和O2混合
3.NO和O2混合 
4.NO2、NO、O2的混合
当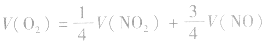 时,反应后无气体剩余
时,反应后无气体剩余
特例:当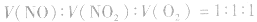 时,无气体剩余。
时,无气体剩余。
由于核外电子排布的周期性变化,使元素表现出不同的性质。元素性质与原子结构密切相关,主要与原子核外电子排布,特别是最外层电子数有关。
碱金属元素的性质:
(1)元素性质同:均为活泼金属元素,最高正价均为+1价异:失电子能力依次增强,金属性依次增强
(2)单质性质同:均为强还原性(均与O2、X2等非金属反应,均能与水反应生成碱和氢气。),银白色,均具轻、软、易熔的特点异:与水(或酸)反应置换出氢依次变易,还原性依次增强,密度趋向增大,熔沸点依次降低,硬度趋向减小
(3)化合物性质
同:氢氧化物都是强碱。过氧化物M2O2具有漂白性,均与水反应产生O2;异:氢氧化物的碱性依次增强。
注: ①Li比煤油轻,故不能保存在煤油中,而封存在石蜡中。 ②Rb,Cs比水重,故与水反应时,应沉在水底。③与O2反应时,Li为Li2O;Na可为Na2O,Na2O2;K,Rb,Cs的反应生成物更复杂。
卤族元素的性质:
(1)相似性:
①卤素原子最外层都有七个电子,易得到一个电子形成稀有气体元素的稳定结构,因此卤素的负价均为-1价。氯、溴、碘的最高正价为+7价,有的还有+1、+3、+5价,其最高价氧化物及水化物的化学式通式分别为X2O7和HXO4(F除外)
②卤族元素的单质均为双原子分子(X2);均能与H2化合:H2+X2=2HX;均能与水不同程度反应,其通式(除F2外)为:H2O+X2
 HX+HXO;均能与碱溶液反应;Cl2、Br2、I2在水中的溶解度较小(逐渐减小,但在有机溶剂中溶解度较大,相似相溶)。
HX+HXO;均能与碱溶液反应;Cl2、Br2、I2在水中的溶解度较小(逐渐减小,但在有机溶剂中溶解度较大,相似相溶)。 (2)递变性:
①原子序数增大,原子的电子层数增加,原子半径增大,元素的非金属性减弱。
②单质的颜色逐渐加深从淡黄绿色→黄绿色→深红棕色→紫黑色,状态从气→气→液→固,溶沸点逐渐升高;得电子能力逐渐减弱,单质的氧化性逐渐减弱,与氢气化合由易到难,与水反应的程度逐渐减弱。
③阴离子的还原性逐渐增强。
④氢化物的稳定性逐渐减弱。
⑤最高正价含氧酸的酸性逐渐减弱(氟没有含氧酸)。
元素周期表编排原则:
(1)把电子层数相同的各种元素按原子序数递增的顺序从左至右排成横行。
(2)把最外层电子数相同的元素按电子层数递增的顺序由上到下排列成纵行。
注意:①元素周期表是元素周期律的具体表现形式,它反映了元素之间相互联系的规律。
②历史上第一个元素周期表是1869年俄国化学家门捷列夫在前人探索的基础上排成的,他将元素按相对原子质量由小到大依次排列,并将化学性质相似的元素放在一个纵行。
元素周期表的结构:
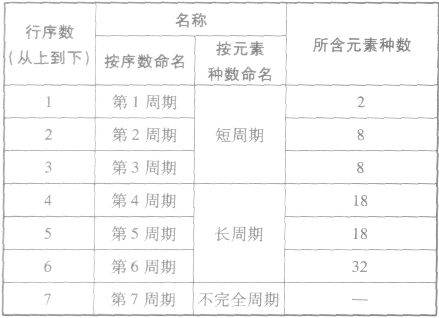
(1)周期
①周期的含义在元素周期表中,把电子层数相同的元素,按原子序数递增的顺序从左到右排成横行,这样每个横行为一个周期。现在使用的元素周期表有7个横行,即7 个周期。
②周期的划分
(2)族
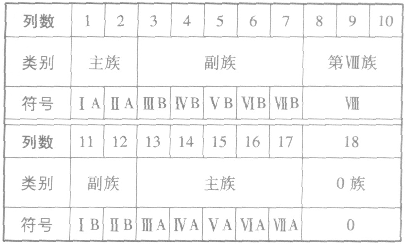
①族的含义在周期表中,把不同横行(即周期)中最外层电子数相同的元素,按电子层数递增的顺序由上到下排成纵行,除第8、9、10三个纵行叫做第Ⅷ族外,其余15个纵行,每个纵行为一族。现在使用的元素周期表有18 个纵行,它们被划分为16个族。
②族的划分
(3)元素周期表中主族元素金属性和非金属性的递变
定义:
在化学反应中,一般是原子的最外层电子数目发生变化。为了简便起见,化学中常在元素符号周围用小黑点“· ”或小叉“×”来表示元素原子的最外层电子,相应的式子叫做电子式。
(1)原子的电子式:H· 、Na· 、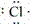
(2)阳离子的电子式:不画出离子最外层电子数,元素右上角标出“n+”电荷字样:Na+、Al3+、Mg2+
(3)阴离子的电子式:要画出最外层电子数,用 “[ ]”括起来,右上角标出“n-”: 、
、 、
、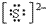
(4)离子化合物的电子式:由阴、阳离子的电子式组成,相同离子不能合并: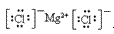 、
、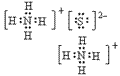
(5)共价化合物的电子式:画出离子最外层电子数: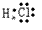 、
、
(6)用电子式表示物质形成的过程:
氯化氢的形成过程: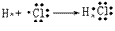
氯化镁的形成过程: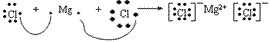
结构式:
共价键中的每一对共用电子用一根短线表示,未成键电子不写出,物质的电子式就变成了结构式。
例如: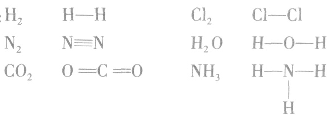
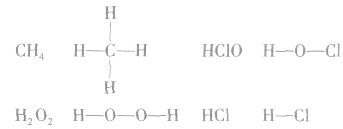
书写电子式的常见错误:
1.漏写未参与成键的电子,如: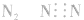
2.化合物类型不清,漏写或多写“[]”及错写电荷数,如: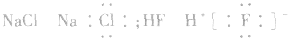
3.书写不规范,错写共用电子对如:N2的电子式为: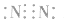 ,不能写成:
,不能写成: ,更不能写成:
,更不能写成: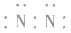 或
或 。
。
4.不考虑原子间的结合顺序如:HClO的电子式为 ,而非
,而非 。因氧原子需形成2对共用电子才能达到稳定结构,而H、 Cl各需形成1对共用电子就能达到稳定结构。
。因氧原子需形成2对共用电子才能达到稳定结构,而H、 Cl各需形成1对共用电子就能达到稳定结构。
5.不考虑原子最外层有几个电子均写成8电子结构如: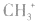 的电子式为
的电子式为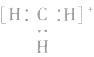 ,而非
,而非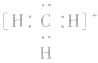 , 因
, 因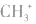 中碳原子最外层应有6个电子(包括共用电子),而非8个电子。
中碳原子最外层应有6个电子(包括共用电子),而非8个电子。
6.不清楚A如型离子化合物中两个B是分开写还是写一块如: 中
中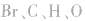 均为-l 价,Br-、H-已达到稳定结构,应分开写;C原子得一个电子,最外层有5个电子,需形成三对共用电子才能达到稳定结构,不能分开写;氧原子得一个电子,最外层有7个电子,需形成一对共用电子才能达到稳定结构,也不能分开写。它们的电子式分别为:
均为-l 价,Br-、H-已达到稳定结构,应分开写;C原子得一个电子,最外层有5个电子,需形成三对共用电子才能达到稳定结构,不能分开写;氧原子得一个电子,最外层有7个电子,需形成一对共用电子才能达到稳定结构,也不能分开写。它们的电子式分别为: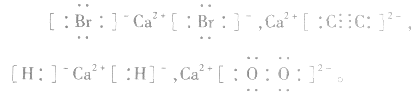
与“下面是元素周期表的简略框架图。回答下列问题:(1)元素a在...”考查相似的试题有:
- 下列有关物质的性质或应用的说法正确的是( )A.一定条件下,镁和铁的单质与水反应都有氢气生成B.二氧化硫有漂白、杀菌性能...
- 下列各项操作中不发生先沉淀后溶解现象的是①向饱和碳酸钠溶液中通入过量的CO2②向Fe(OH)3胶体中逐滴滴加入过量H2SO4③向Ba(NO3)...
- 下列有关推断中,不正确的是 事 实结 论ACaCO3+2CH3COOH=(CH3COO)2Ca +CO2↑+H2O酸性: CH3COOH> H2CO3B氢硫酸(H2S)放置在...
- 下列各组描述正确的是A.化工生产要遵守三原则:充分利用原料、充分利用能量、保护环境。①燃烧时使用沸腾炉②制盐酸时将氯气在...
- X.Y均为元素周期表中前20号元素,其简单离子的电子层结构相同,下列说法正确的是[ ]A.若x、Y的简单离子分别表示为mXa+、nYb-...
- A、B、C、D 4种元素,A元素所处的周期数、主族序数、原子序数均相等;B的原子半径是其所在主族中最小的,B的最高价氧化物对应...
- 解释下列物质性质的变化规律与物质结构间的因果关系时,与键能无关的变化规律是( )A.HF、HCl、HBr、HI的热稳定性依次减弱B...
- A~L是由6种短周期元素组成的物质,各物质之间有如下转化关系:已知:(a) C、E是气体单质,F是日常生活中的常用金属;(b)...
- 某非金属单质A经如下图所示的过程转化为含氧酸D,已知D为强酸,请回答:(1)若A常温下为淡黄色固体,B是有刺激性气味的无色...
- 用A+、B-、C2-、D、E、F、G和H分别表示含有18 个电子的八种微粒(离子或分子),请回答:(1)A元素是___ 、B元素是____、C元...