本试题 “欲使0.1mol/L的Na2CO3溶液中c(Na+)接近2c(CO32-),应采取的措施是[ ]A.适当加热B.适量加水C.适量加盐酸D.适量加KOH” 主要考查您对盐水解的影响因素
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 盐水解的影响因素
影响盐类水解平衡的因素:
主要因素是盐本身的性质,组成的盐的酸根对应的酸越弱(或阳离子对应的碱越弱),水解程度就越大,另外还受温度、浓度及外加酸碱等因素的影响。
(1)温度:盐的水解是吸热反应,因此升高温度水解程度增大;
(2)浓度:盐的浓度越小,水解程度越大,但溶液的酸碱性一般越弱;
(3)外加酸碱:外加酸碱能促进或抑制盐的水解,使盐的水解程度降低,但由于酸(或碱)的加入,使溶液的酸(碱性)增强。
例如: 外界条件对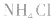 水解平衡
水解平衡
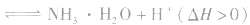 的影响
的影响
(4)能水解的阳离子与能水解的阴离子混合,会相互促进水解。常见的含下列离子的两种盐混合时,会发生较彻底的双水解反应:阳离子:Fe3+、Al3+;阴离子:CO32-、HCO3-、S2-、HS-、AlO2-、SO32-、HSO3-等。
(5)Fe3+与S2-、HS-、SO32-、HSO3-等还原性离子发生氧化还原反应,而不是发生双水解反应。
(6)HCO3-与AlO2-在溶液中也不能共存,可发生反应产生白色沉淀,但不是由于双水解反应,而是:
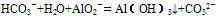
主要因素是盐本身的性质,组成的盐的酸根对应的酸越弱(或阳离子对应的碱越弱),水解程度就越大,另外还受温度、浓度及外加酸碱等因素的影响。
(1)温度:盐的水解是吸热反应,因此升高温度水解程度增大;
(2)浓度:盐的浓度越小,水解程度越大,但溶液的酸碱性一般越弱;
(3)外加酸碱:外加酸碱能促进或抑制盐的水解,使盐的水解程度降低,但由于酸(或碱)的加入,使溶液的酸(碱性)增强。
例如: 外界条件对
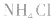 水解平衡
水解平衡
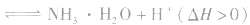 的影响
的影响
(4)能水解的阳离子与能水解的阴离子混合,会相互促进水解。常见的含下列离子的两种盐混合时,会发生较彻底的双水解反应:阳离子:Fe3+、Al3+;阴离子:CO32-、HCO3-、S2-、HS-、AlO2-、SO32-、HSO3-等。
(5)Fe3+与S2-、HS-、SO32-、HSO3-等还原性离子发生氧化还原反应,而不是发生双水解反应。
(6)HCO3-与AlO2-在溶液中也不能共存,可发生反应产生白色沉淀,但不是由于双水解反应,而是:
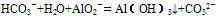
盐类水解程度大小比较规律:
1.盐水解生成的弱酸(或弱碱)越弱,水解程度越大。常据此判断弱酸(或弱碱)的相对强弱:如等浓度的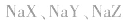 三种盐溶液,pH依次增大,则弱酸根离子
三种盐溶液,pH依次增大,则弱酸根离子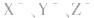 的水解程度依次增大,所以酸性HX>HY>HZ。
的水解程度依次增大,所以酸性HX>HY>HZ。
2.相同条件下:正盐>相应酸式盐。如水解程度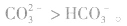
3.相互促进水解的盐>单水解的盐>相互抑制水解的盐。如水解程度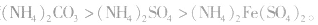
发现相似题
与“欲使0.1mol/L的Na2CO3溶液中c(Na+)接近2c(CO32-),应采取的...”考查相似的试题有:
- pH=2的某酸HnA与pH=12的某碱B(OH)m等体积混合后溶液的pH=8。(1)写出正盐的化学式:______________________________。(2...
- 把0.2 mol•L-1CH3COOH溶液与0.1 mol•L-1NaOH溶液等体积混合,溶液显酸性,下列叙述正确的是A.c(CH3COO-)>c(Na+)B.c(CH3...
- 等浓度的NaOH溶液与氢硫酸溶液反应,下列说法不正确的是A.溶液中始终有:c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-)B.溶液呈中性...
- 下列比较中,正确的是( )A.同温度同物质的量浓度时,HF比HCN易电离,则NaF溶液的pH比NaCN溶液大B.0.2 mol ·LNH4Cl和0.1...
- 物质的量浓度相等的下列溶液pH值由大到小的顺序是A.Na2CO3、NaHCO3、NaCl、NH4ClB.Na2CO3、NaHCO3、NH4Cl、NaCl、C.Na2CO3...
- 下列关系式正确的是A.常温下PH=2的甲酸与pH=12的烧碱溶液等体积混合:B.溶液中:C.溶液加水稀释后,恢复至原温度,所有离子...
- 常温下有浓度均为0.5 mol·L-1的四种溶液:①碳酸钠溶液②碳酸氢钠溶液③盐酸④氨水。请根据题目要求回答下列问题:(1)上述溶液中...
- 实验室配制有0.1mol/L的Na2CO3溶液,根据电离平衡和水解知识,回答下列有关问题:⑴写出H2CO3的电离方程式为 ;⑵Na2CO3溶液显...
- 下列物质溶解于水时,电离出的阴离子能使水的电离平衡向右移动的是( )A.Na2SO4B.CH3COONaC.NH4ClD.HClO
- 下列说法错误的是( )A.向Na2S 溶液中滴入酚酞试液,呈红色B.升高温度能使FeCl3溶液中c(H+)增大C.一切钾盐,钠盐,硝酸盐都不...