本试题 “二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。请回答下列问题:(1)煤的气...” 主要考查您对碳酸钠
硫化氢
盖斯定律
化学平衡常数
影响化学平衡的因素
煤的综合利用
化学反应速率的计算
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 碳酸钠
- 硫化氢
- 盖斯定律
- 化学平衡常数
- 影响化学平衡的因素
- 煤的综合利用
- 化学反应速率的计算
碳酸钠(Na2CO3):
(1)俗名:纯碱或苏打;白色粉末,易溶于水,稳定;可用于制玻璃、肥皂、造纸、防治等
(2)与H+反应:CO32-+2H+==CO2↑+H2O
(3)与NaOH不反应
(4)与石灰水反应:CO32-+Ca2+==CaCO3↓
(5)与氯化钡反应:CO32-+Ba2+==BaCO3↓
(6)与CO2反应:CO32-+CO2+H2O==2HCO3-
碳酸钠的物理性质:
碳酸钠常温下为白色粉末或颗粒。溶于水和甘油,不溶于乙醇。水溶液呈强碱性,pH11.6。
碳酸钠是一种强碱盐,溶于水后发生水解反应(碳酸钠水解会产生碳酸氢钠和氢氧化钠),使溶液显碱性,有一定的腐蚀性,能与酸进行复分解反应。
稳定性 稳定性较强,但高温下也可分解,生成氧化钠和二氧化碳。长期暴露在空气中能吸收空气中的水分及二氧化碳,生成碳酸氢钠,并结成硬块。吸湿性很强,很容易结成硬块,在高温下也不分解。含有结晶水的碳酸钠有3种:Na2CO3·H2O、Na2CO3·7H2O和Na2CO3·10H2O。
碳酸钠的用途:
用于制玻璃、肥皂、造纸、纺织等工业,也用作食品工业发酵剂。
Na2CO3、NaHCO3的性质比较:
| 表示 | 名称 | 碳酸钠 | 碳酸氢钠 |
| 化学式 | Na2CO3 | NaHCO3 | |
| 俗称 | 苏打 | 小苏打 | |
| 物理性质 | 色态 | 白色粉末 | 白色晶体 |
| 溶解性 | 易溶于水 | 能溶于水 | |
| 化学性质 | 与盐酸反应 | Na2CO3+2HCl=2NaCl+H2O+CO2↑ | NaHCO3+HCl=NaCl+H2O+CO2↑ |
| 热稳定性 | 很稳定 | 受热分解:2NaHCO3=(加热)=Na2CO3+H2O+CO2↑ | |
| 与NaOH反应 | 不反应 | NaHCO3+NaOH=Na2CO3+H2O | |
| 相互转化 | Na2CO3+H2O+CO2=2NaHCO3 | NaHCO3+NaOH=Na2CO3+H2O 2NaHCO3=(加热)=Na2CO3+H2O+CO2↑ |
Na2CO3、NaHCO3的鉴别:

Na2CO3、NaHCO3与足量盐酸反应的比较:
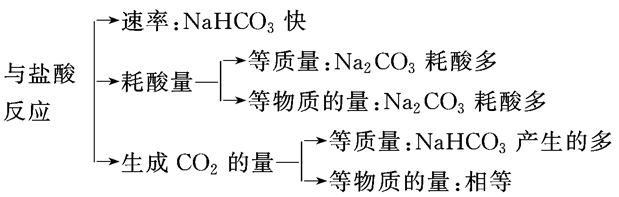
Na2CO3溶液与盐酸反应:
滴加顺序不同,现象不同,化学方程式不同。
①向盐酸里逐滴加入Na2CO3溶液(开始时酸过量) 2HCl+Na2CO3===2NaCl+CO2↑+H2O
②向Na2CO3溶液里逐滴加入盐酸(开始时酸不足) HCl+Na2CO3==NaCl+NaHCO3(无气泡) HCl+NaHCO3==NaCl+CO2↑+H2O(后来有气泡)
[特别提醒]
(1)Na2CO3和盐酸可以用互滴法鉴别。
(2)滴加顺序不同,放出CO2的量可能相同,也可能不同。
碳酸钠、碳酸氢钠与盐酸反应的基本图像的归纳总结:
(1)向Na2CO3中逐滴加入盐酸,消耗HCl的体积与产生CO2的体积的关系如图1所示;
(2)向NaHCO3中逐滴加入盐酸,消耗HCl的体积与产生CO2的体积的关系如图2所示;
(3)向NaOH、Na2CO3的混合物中逐滴加入盐酸,消耗HCl的体积与产生CO2的体积的关系如图3所示(设NaOH、Na2CO3的物质的量之比x∶y=1∶1,其他比例时的图像略);
(4)向Na2CO3、NaHCO3的混合物中逐滴加入盐酸,消耗HCl的体积与产生CO2的体积的关系如图4所示(设Na2CO3、NaHCO3的物质的量之比m∶n=1∶1,其他比例时的图像略)。
硫化氢:
H2S的分子结构与H2O相似,呈角形,是一种极性分子,但极性比水弱,不能形成氢键。熔点(-86℃) 和沸点(-71℃)都比水低。
硫化氢的物理性质和化学性质:
1.物理性质:H2S是一种无色,有臭鸡蛋气味的气体,比空气稍重,能溶于水(常温常压下,1体积水中能溶解2.6体积硫化氢)。
2.化学性质:
(1)对热较不稳定

(2)强还原性 
3.氢硫酸氢硫酸是二元弱酸,可分步电离:
具有挥发性,能使石蕊试液变红。氢硫酸具有酸的通性。 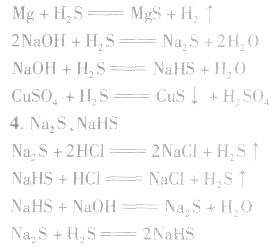
Na2S、NaHS均具有强还原性,在空气中均易被氧化。
S2-遇Fe3+、ClO-、NO3-(H+)等氧化性离子都发生氧化还原反应。
不管化学反应是一步完成还是分几步完成,其反应热是相同的。换句话说,化学反应的反应热只与反应的始态和终态有关,而与反应进行的途径无关。如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一一步完成时的反应热是相同的,这就是盖斯定律。
盖斯定律的意义:
利用盖斯定律可以间接计算某些不能直接测得的反应的反应热。例如:
 的△H无法直接测得,可以结合下面两个反应的△H,利用盖斯定律进行计算。
的△H无法直接测得,可以结合下面两个反应的△H,利用盖斯定律进行计算。
根据盖斯定律,就可以计算出所给反应的△H。分析上述两个反应的关系,即知


盖斯定律在反应热大小比较中的应用:
1.同一反应生成物状态不同时

若按以下思路分析:

2.同一反应物状态不同时

3.两个有联系的不同反应相比

并且据此可写出下面的热化学方程式:


在一定温度下,可逆反应无论从正反应开始,还是从逆反应开始,也不管反应物起始浓度大小,最后都达到平衡,这时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值是个常数,用K表示,这个常数叫化学平衡常数。
化学表平衡达式:
对于可逆反应mA(g)+nB(g)
 pC(g)+qD(g)来说,化学平衡表达式:
pC(g)+qD(g)来说,化学平衡表达式: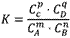
化学平衡常数的意义:
①表示该反应在一定温度下,达到平衡时进行的程度,K值越大,正反应进行的越彻底,对反应物而言转化率越高。
②某一温度下的K′与K比较能够判断反应进行的方向
K′>K,反应正向进行;K′<K,反应逆向进行;K′=K,反应处于平衡状态
(3)化学平衡常数与浓度、压强、催化剂无关,与温度有关,在使用时必须指明温度。
(4)在计算平衡常数时,必须是平衡状态时的浓度。
(5)对于固体或纯液体而言,其浓度为定值,可以不列入其中。
(6)化学平衡常数是指某一具体反应的平衡常数,若反应方向改变,则平衡常数改变,且互为倒数关系。如:在一定温度下,
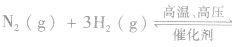


化学平衡常数的应用:
1.K值越大,说明平衡体系中生成物所占的比例越大,正向反应进行的程度越大,反应物转化率越大;反之,正向反应进行的程度就越小,反应物转化率就越小,即平衡常数的大小可以衡量反应进行的程度,判断平衡移动的方向,进行平衡的相关计算。
2.若用浓度商(任意状态的生成物浓度幂之积与反应物浓度幂之积的比值,符号为Qc)与K比较,可判断可逆反应是否达到平衡状态和反应进行的方向。
3.利用K值可判断反应的热效应若升高温度,K值增大,则正反应为吸热反应;若升高温度,K值减小,则正反应为放热反应。
4.计算转化率及浓度依据起始浓度(或平衡浓度)和平衡常数可以计算平衡浓度(或起始浓度),从而计算反应物的转化率。
(1)浓度在其他条件不变的情况下,增大反应物的浓度或减小生成物的浓度,都可以使化学平衡向正反应方向移动;增大生成物的浓度或减小反应物的浓度,都可以使化学平衡向逆反应方向移动。
(2)压强对反应前后气体总体积发生变化的反应,在其他条件不变时,增大压强会使平衡向气体体积缩小的方向移动,减小压强会使平衡向气体体积增大的方向移动。对于反应
 来说,加压,
来说,加压,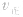 增大、
增大、 增大,
增大,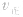 增大的倍数大,平衡向正反应方向移动:若减压,
增大的倍数大,平衡向正反应方向移动:若减压,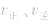 均减小,
均减小,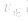 减小的倍数大,平衡向逆反应方向移动,加压、减压后v一t关系图像如下图:
减小的倍数大,平衡向逆反应方向移动,加压、减压后v一t关系图像如下图: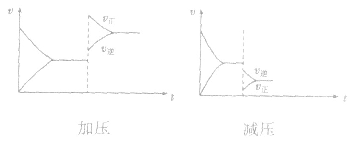
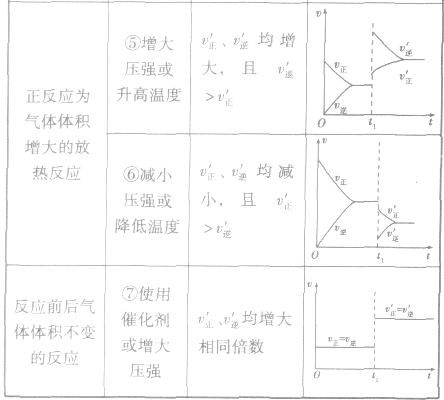
(3)温度在其他条件不变时,温度升高平衡向吸热反应的方向移动,温度降低平衡向放热反应的方向移动
对于
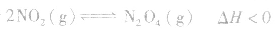 ,加热时颜色变深,降温时颜色变浅。该反应升温、降温时,v—t天系图像如下图:
,加热时颜色变深,降温时颜色变浅。该反应升温、降温时,v—t天系图像如下图: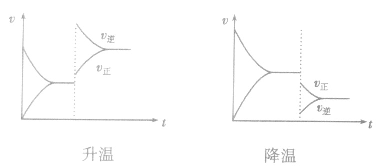
(4)催化剂由于催化剂能同等程度地改变正、逆反应速率,所以催化剂对化学平衡无影响,v一t图像为
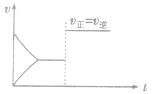
稀有气体对化学反应速率和化学平衡的影响分析:
1.恒温恒容时
充入稀有气体
 体系总压强增大,但各反应成分分压不变,即各反应成分的浓度不变,化学反应速率不变,平衡不移动。
体系总压强增大,但各反应成分分压不变,即各反应成分的浓度不变,化学反应速率不变,平衡不移动。 2.恒温恒压时
充入稀有气体
 容器容积增大
容器容积增大 各反应成分浓度降低
各反应成分浓度降低 反应速率减小,平衡向气体体积增大的方向移动。
反应速率减小,平衡向气体体积增大的方向移动。3.当充入与反应无关的其他气体时,分析方法与充入稀有气体相同。
化学平衡图像:
1.速率一时间因此类图像定性揭示了
 随时间(含条件改变对化学反应速率的影响)变化的观律,体现了平衡的“动、等、定、变”的基本特征,以及平衡移动的方向等。
随时间(含条件改变对化学反应速率的影响)变化的观律,体现了平衡的“动、等、定、变”的基本特征,以及平衡移动的方向等。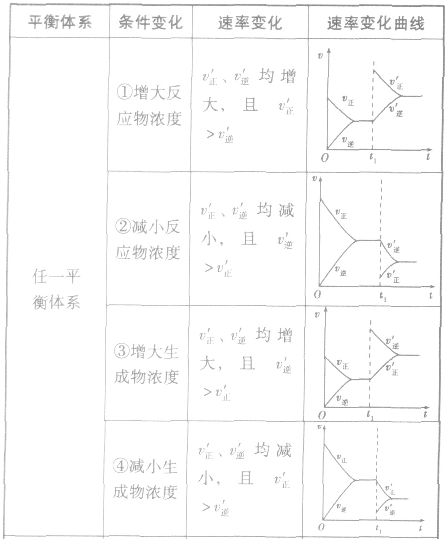
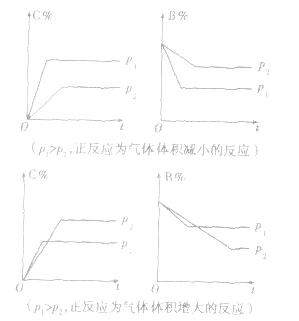
2.含量一时间一温度(压强)图常见的形式有下图所示的几种(C%指某产物百分含量,B%指某反应物百分含量),这些图像的折点表示达到平衡的时间,曲线的斜率反映了反应速率的大小,可以确定T(p)的高低(大小),水平线高低反映平衡移动的方向。

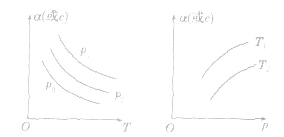
3.恒压(温)线该类图像的纵坐标为物质的平衡浓发(c)或反应物的转化率(α),横坐标为温度(T)或压强 (p),常见类型如下图:
小结:
1.图像分析应注意“三看”
(1)看两轴:认清两轴所表示的含义。
(2)看起点:从图像纵轴上的起点,一般可判断谁为反应物,谁为生成物以及平衡前反应进行的方向。
(3)看拐点:一般图像在拐点后平行于横轴则表示反应达平衡,如横轴为时间,由拐点可判断反应速率。
2.图像分析中,对于温度、浓度、压强三个因素,一般采用“定二议一”的方式进行分析
平衡移动方向与反应物转化率的关系:
1.温度或压强改变引起平衡向正反应方向移动时,反应物的转化率必然增大。
2.反应物用量的改变
(1)若反应物只有一种时,如aA(g)
 bB(g)+ cc(g),增加A的量,平衡向正反应方向移动,但反应物 A的转化率与气体物质的化学计量数有关:
bB(g)+ cc(g),增加A的量,平衡向正反应方向移动,但反应物 A的转化率与气体物质的化学计量数有关:
(2)若反应物不止一种时,如aA(g)+bB(g)
 cC(g)+dD(g):
cC(g)+dD(g): a.若只增加A的量,平衡向正反应方向移动,而A的转化率减小,B的转化率增大。
b.若按原比例同倍数的增加反应物A和B的量,则平衡向正反应方向移动,而反应物的转化率与气体物质的计量数有关:

c.若不同倍增加A、B的量,相当于增加了一种物质,同a。
3.催化剂不改变转化率。
4.反应物起始的物质的量之比等于化学计量数之比时,各反应物转化率相等。
浓度、压强影响化学平衡的几种特殊情况:
1.当反应混合物中存在固体或纯液体物质时,由于其“浓度”是恒定的,不随其量的增减而变化,故改变这些固体或纯液体的量,对平衡基本无影响。
2.南于压强的变化对非气态物质的浓度基本无影响,因此,当反应混合物中不存在气态物质时,压强的变化对平衡无影响。
3.对于气体分子数无变化的反应,如
 ,压强的变化对其平衡无影响。这是因为,在这种情况下,压强的变化对正、逆反应速率的影响程度是等同的,故平衡不移动。
,压强的变化对其平衡无影响。这是因为,在这种情况下,压强的变化对正、逆反应速率的影响程度是等同的,故平衡不移动。 4.对于有气体参加的反应,同等程度地改变反应混合物中各物质的浓度,应视为压强对平衡的影响,如某平衡体系中,
 ,
,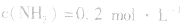 ,当浓度同时增大一倍时,即让
,当浓度同时增大一倍时,即让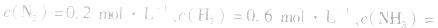
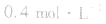 ,此时相当于压强增大一倍,平衡向生成NH3的方向移动。
,此时相当于压强增大一倍,平衡向生成NH3的方向移动。 5.在恒容的密闭容器中,当改变其中一种气体物质的浓度时,必然同时引起压强改变,但判断平衡移动的方向时,心仍从浓度的影响去考虑:如
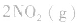
 ,平衡后,向容器中再通入反应物
,平衡后,向容器中再通入反应物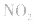 ,使 c(NO2)增大,平衡正向移动;如向容器中再通入生成物 N2O4,则使c(N2O4)增大,平衡逆向移动。但由于两种情况下,容器内的压强都增大,故对最终平衡状态的影响是一致的,如两种情况下,重新达到平衡后,NO2的百分含量都比原平衡时要小
,使 c(NO2)增大,平衡正向移动;如向容器中再通入生成物 N2O4,则使c(N2O4)增大,平衡逆向移动。但由于两种情况下,容器内的压强都增大,故对最终平衡状态的影响是一致的,如两种情况下,重新达到平衡后,NO2的百分含量都比原平衡时要小①煤的汽化:
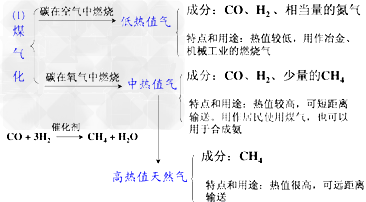
②煤的干馏:把煤隔绝空气加强热使它分解的过程,叫做煤的干馏

③煤的液化:煤的液化分直接液化和间接液化两种。

化学反应速率的求算:
首先要熟练掌握化学反应速率的含义,明确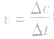 中各个量的含义和单位,如:以具体某一种物质 B表示的化学反应速率为
中各个量的含义和单位,如:以具体某一种物质 B表示的化学反应速率为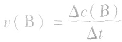 。△c的单位一般用mol/L表示,而△t的单位一般用s(秒)、min (分钟)、h(小时)等表示,所以v的单位可以是
。△c的单位一般用mol/L表示,而△t的单位一般用s(秒)、min (分钟)、h(小时)等表示,所以v的单位可以是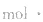

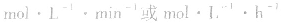 等。对于反应
等。对于反应 ,有
,有 ,利用这一关系,可以很方便地求算出不同物质表示的v的数值:
,利用这一关系,可以很方便地求算出不同物质表示的v的数值:
化学反应速率图像及其应用:
1.物质的量(或浓度)一时间图像及应用此类图像能说明反应体系各组分(或某一组分)在反应过程中的浓度变化情况。如A(g) +B(g)
 3C(g)的反应情况如图所示,
3C(g)的反应情况如图所示,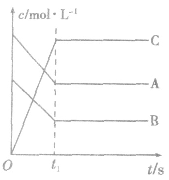
要注意此类图像各曲线的折点(达平衡)时刻相同,各物质浓度变化符合化学方程式中的计量数关系。例如:某温度时,在恒容(VL)容器中,X、Y、z三种物质的物质的量随时间的变化曲线如下图所示。
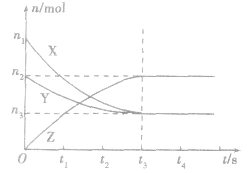
根据图像可进行如下计算:
(1)计算某物质在O一t3刻的平均反应速率、转化率,如
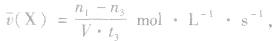 Y的转化率为
Y的转化率为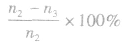 .
.(2)确定化学方程式中各物质的化学计量数之比如X、Y、z三种物质的化学计量数之比为: (n1一n3):(n2一n3):n2。
2.全程速率一时间图像如Zn与足量盐酸的反应,反应速率随时间的变化出现的情况,如图所示,

解释原因:AB段(v增大),因反应为放热反应,随反应的进行,温度升高,导致反应速率增大;BC段(v减小),则主要因为随反应的进行,溶液中 c(H+)减小,导致反应速率减小。故分析时要抓住各阶段的主要矛盾,认真分析。
3.速率一温度(压强)图像这类图像有两种情况:一是不隐含时间变化的速率一温度(压强)图,二是隐含时间变化的速率一温度 (压强)图。以
 ,△H< 0为例,V一T(P)图像如下:
,△H< 0为例,V一T(P)图像如下: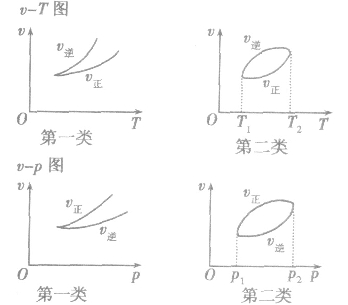
与“二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对...”考查相似的试题有:
- (1)真空碳热还原-氯化法可实现由铝土矿制备金属铝,相关反应的热化学方程式如下:Al2O3(s)+AlCl3(g)+3C(s)═3AlCl(g...
- 一定温度下,在容积为V L的密闭容器中进行反应:aN(g)bM(g),M、N的物质的量随时间的变化曲线如图所示:(1)此反应的化学...
- 高中化学《化学反应原理》选修模块从不同的视角对化学反应进行了探究、分析.以下观点中不正确的是( )①放热反应在常温下均...
- 在密闭容中发生下列反应aA(g)cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平...
- 甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇。(1)将1 mol CH4和2 mol H2O(g)通入反...
- 苯乙烯(C6H5CH=CH2)是生产各种塑料的重要单体,其制备原理是:C6H5C2H5(g)C6H5CH=CH2(g)+H2(g) △H=+125kJ/mol(1)该反应的平衡...
- 对于可逆反应:2A(g)+B(g)2C(g) △H <0,下列各图正确的是( )
- 如下图所示,图Ⅰ是恒压密闭容器,图Ⅱ是恒容密闭容器。当其它条件相同时,在Ⅰ、Ⅱ中分别加入2 mol X和2 mol Y,开始时容器的体...
- 在一定温度下合成氨的反应达到平衡后,再进行下列操作,平衡不移动的是( )A.恒温、恒压条件下充入氨气B.恒温、恒压条件下...
- 在mA+nBpC的反应中m、n、p为各物质的化学计量数,现测得C每分钟增加amol·L-1,B每分钟减小1.5amol·L-1,A每分钟减少0.5a mol·...