本试题 “在化学分析中,为了测定某试样中FeSO4·7H2O的质量分数,一般采用在酸性条件下用高锰酸钾标准溶液滴定的方法,反应原理为:5Fe2++8H++ MnO4-=5Fe3++Mn2++4H2O...” 主要考查您对测定物质组成、成分含量
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 测定物质组成、成分含量
定量实验介绍:

燃烧法测定氨基酸的组成:
实验室用燃烧法测定某种氨基酸(CxHyOzNp)的分子组成。取Wg该种氨基酸放在纯氧中充分燃烧,生成CO2、H2O和N2。现按下图所示装置进行实验。

①实验开始时,首先要通入一段时间的氧气,目的是排除体系中的N2。
②D装置的作用是吸收未反应的O2,保证最终收集的气体是N2。
③读取N2体积时,应注意:量筒内液面与广口瓶中的液面相持平视线与凹液面最低处相切。
④实验中测得N2的体积为VmL(已折算为标准状况)。为确定此氨基酸的分子式,还需要的有关数据为生成二氧化碳气体的质量、生成水的质量、氨基酸的相对分子质量
用氨气还原氧化铜的方法测定铜的近似相对原子质量:
实验室用氨气还原氧化铜的方法测定铜的近似相对原子质量,反应的化学方程式为:2NH3+3CuO
 N2+3Cu+3H2O
N2+3Cu+3H2O(1)如果选用测定反应物CuO和生成物H2O的质量[m(CuO)、m(H2O)]时,请用下列仪器设计一个简单的实验方案。
装置图:
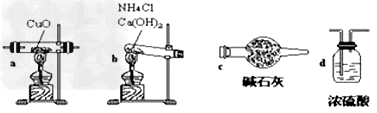
①连接顺序为:bcacd
②d中浓硫酸的作用是吸收未反应的氨、防止空气中水分进入;实验完毕时观察到a中的现象是固体由黑色转变为红色;
③Cu的相对原子质量的表达式
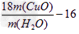
发现相似题
与“在化学分析中,为了测定某试样中FeSO4·7H2O的质量分数,一般...”考查相似的试题有:
- 某有机物在氧气中充分燃烧,只生成水蒸气和二氧化碳,且两者物质的量之比为1:1,由此可以得出的结论是( )A.可以推算出该...
- 某化学课外研究小组拟对一种焰火原料(由两种短周期中的常见金属元素的单质组成的合金粉末)进行探究.请完成下列探究报告....
- 以钡矿粉(主要成份为BaCO3,含有Ca2+、Fe2+、Fe3+、Mg2+等)制备BaCl2•2H2O的流程如下:(1)氧化过程主要反应的离子方程式...
- 某中学探究性学习小组用如图所示的装置进行实验,在室温和1标准大气压强下,测得 ag含Al 96%的样品甲与稀硫酸完全反应产生的...
- 三氧化二铁和氧化亚铜都是红色粉末,常用作颜料.某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物.探...
- 下列判断正确的是[ ]A.测定硫酸铜晶体中结晶水含量时,灼烧至固体发黑,测定值小于理论值B.相同条件下,2 mol 氢原子所具有...
- 已知FeSO4在不同条件下分解得到的产物不同,可能是FeO和SO3,也可能是Fe2O3、SO3和SO2.某研究小组探究在酒精喷灯加热条件下F...
- 有一固体混合物,可能由Na2CO3、Na2SO4、CuSO4、CaCl2、KCl等混合而成,为检验它们,做了如下实验:①将固体混合物溶于水,搅...
- (1)有A、B、C三瓶失去标签的无色溶液:K2CO3、BaCl2、NaSO4.将它们分别与H2SO4作用,A产生白色沉淀,B产生无色气体,C中无...
- 在A、B、C、D的四支试管中分别盛有NaHSO4、Na2CO3、BaCl2、BaCO3固体,在只有蒸馏水和若干试管的条件下,将它们一一鉴别出来...