本试题 “已知酸式盐NaHB在水溶液中存在下列反应: ①NaHB==Na++HB-,②HB-H++B2-,③HB-+H2OH2B+OH-且溶液中c(H+)>c(OH-),则下列说法一定正确的是[ ]A.NaH...” 主要考查您对弱电解质的电离
强电解质、弱电解质
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 弱电解质的电离
- 强电解质、弱电解质
定义:
在一定温度、浓度的条件下,弱电解质在溶液中电离成离子的速率与离子结合成分子的速率相等时,电离过程就到了电离平衡状态,叫弱电解质的电离平衡。

电离平衡的特征:
(1)等:
(2)动: 的动态平衡
的动态平衡
(3)定:条件一定,分子与离子浓度一定。
(4)变:条件改变,平衡破坏,发生移动。
在一定温度、浓度的条件下,弱电解质在溶液中电离成离子的速率与离子结合成分子的速率相等时,电离过程就到了电离平衡状态,叫弱电解质的电离平衡。

电离平衡的特征:
(1)等:

(2)动:
 的动态平衡
的动态平衡(3)定:条件一定,分子与离子浓度一定。
(4)变:条件改变,平衡破坏,发生移动。
强电解质:
在水溶液里或熔融状态下,能全部电离的化合物。包括:强酸、强碱、大多数盐、活泼金属氧化物等;完全电离、不可逆、不存在电离平衡;电离方程式用“=”表示。
弱电解质:
在水溶液里或熔融状态下,不能全部电离的化合物。包括:弱酸、弱碱、少数盐等;部分电离、可逆、存在电离平衡,电离方程式用“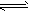 ”表示。
”表示。
在水溶液里或熔融状态下,能全部电离的化合物。包括:强酸、强碱、大多数盐、活泼金属氧化物等;完全电离、不可逆、不存在电离平衡;电离方程式用“=”表示。
弱电解质:
在水溶液里或熔融状态下,不能全部电离的化合物。包括:弱酸、弱碱、少数盐等;部分电离、可逆、存在电离平衡,电离方程式用“
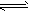 ”表示。
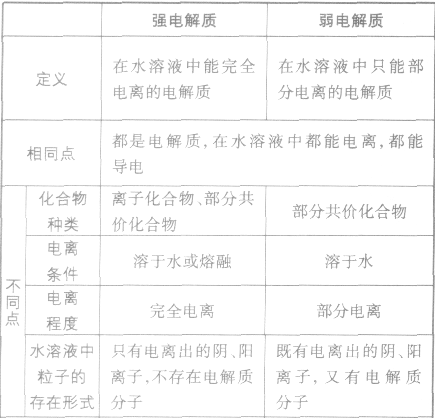
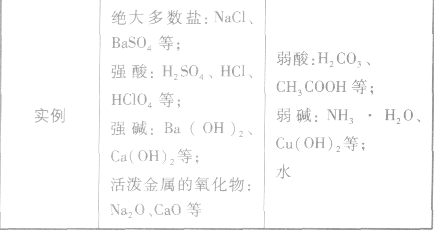
”表示。 强电解质和弱电解质的比较:
强弱电解质的判断依据:
1.在相同浓度、相同温度下,与强电解质做导电性对比实验.
2.浓度与pH的关系。如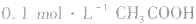 溶液的pH>1,则证明
溶液的pH>1,则证明 是弱电解质。
是弱电解质。
3.测定对应盐溶液的酸碱性。如 溶液呈碱性,则证明醋酸是弱电解质。
溶液呈碱性,则证明醋酸是弱电解质。
4.稀释前后的pH变化与稀释倍数的关系。例如,将pH=2的酸溶液稀释1000倍,若pH<5,则证明该酸为弱电解质;若pH=5,则证明该酸为强电解质。
5.采用实验证明电离平衡。如向醋酸溶液中滴人石蕊试液,溶液变红,再加入醋酸钠晶体,颜色变浅。
发现相似题
与“已知酸式盐NaHB在水溶液中存在下列反应: ①NaHB==Na++HB-,②...”考查相似的试题有:
- 用蒸馏水稀释0.1mol/L的CH3COOH时,始终保持增大趋势的是[ ]A.c(CH3COOH)B.c(H+)C.c(OH-)D.c(CH3COO-)
- 取三份锌粉,分盛于甲、乙、丙三支试管中,分别加入以下物质后,及时塞上导管塞子,充分反应.甲加入50mLpH=2盐酸,乙加入50m...
- 将等质量的锌粒(wg)分别投入VLpH=2的盐酸和醋酸(含醋酸nmol),结果发现一种溶液中Zn有剩余,有关叙述正确的是( )A.0.3...
- 下列事实或变化,能证明一水合氨是弱电解质的是( )A.氨水受热分解挥发出氨气B.氨水与醋酸反应生成醋酸铵,而醋酸铵是强电...
- 下列有关叙述中正确的是:( )A 难溶于水的电解质一定是弱电解质B 强电解质的水溶液导电能力一定比弱电解质水溶液的导电能力强...
- 甲酸和乙酸都是弱酸,当它们的浓度均为0.10 mol·L-1时,甲酸中的c(H+)约为乙酸中c(H+)的3倍。现有两种浓度不等的甲酸溶液a和b...
- pH=l的两种酸溶液A、B各1mL,分别加水稀释到1000mL,其pH与溶液体积的关系如图,下列说法正确的是( )①若a<4,则A、B 都是...
- 下列事实中不能证明是弱电解质的是A.常温下某B.常温下0.1mol溶液的pH=2.8C.溶液与稀盐酸反应生成D.属于共价化合物
- 下列事实能说明亚硝酸是弱电解质的是( )①1LpH=2的亚硝酸溶液与足量Mg反应生成H20.01mol②用HNO2溶液做导电试验,灯泡很暗③HN...
- 下列物质属于电解质的是( )A.氯气B.氯化氢C.蔗糖D.Na2SO4溶液