本试题 “下列关于各装置图的叙述中,正确的是[ ]A.若采用装置①精炼铜,则a极为纯铜,b极为粗铜,电解质溶液为CuSO4溶液B.装置②是原电池,能将化学能转化为电能,锌...” 主要考查您对原电池原理
电解精炼铜
气体的收集、净化、干燥
配制一定物质的量浓度的溶液
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 原电池原理
- 电解精炼铜
- 气体的收集、净化、干燥
- 配制一定物质的量浓度的溶液
原电池:
1.定义:将化学能转化为电能的装置。
2.工作原理:
以铜-锌原电池为例
(1)装置图:

(2)原理图:

3.实质:化学能转化为电能。
4.构成前提:能自发地发生氧化还原反应。
5.电极反应:
负极:失去电子;氧化反应;流出电子
正极:得到电子;氧化反应;流入电子
6.原电池正负极判断的方法:
①由组成原电池的两级材料判断,一般是活泼金属为负极,活泼性较弱的金属或能导电的非金属为正极。
②根据电流方向或电子流动方向判断,电流是由正极流向负极,电子流动方向是由负极流向正极。
③根据原电池里电解质溶液内离子的定向移动方向,在原电池的电解质溶液中,阳离子移向正极,阴离子移向负极。
④根据原电池两级发生的变化来判断,原电池的负极总是失电子发生氧化反应,正极总是得电子发生还原反应。
⑤X极增重或减重:X极质量增加,说明溶液中的阳离子在X极(正极)放电,反之,X极质量减少,说明X极金属溶解,X极为负极。
⑥X极有气泡冒出:发生可析出氢气的反应,说明X极为正极。
⑦X极负极pH变化:析氢或吸氧的电极发生反应后,均能使该电极附近电解质溶液的pH增大,X极附近的pH增大,说明X极为正极。
1.定义:将化学能转化为电能的装置。
2.工作原理:
以铜-锌原电池为例

(1)装置图:

(2)原理图:

3.实质:化学能转化为电能。
4.构成前提:能自发地发生氧化还原反应。
5.电极反应:
负极:失去电子;氧化反应;流出电子
正极:得到电子;氧化反应;流入电子
6.原电池正负极判断的方法:
①由组成原电池的两级材料判断,一般是活泼金属为负极,活泼性较弱的金属或能导电的非金属为正极。
②根据电流方向或电子流动方向判断,电流是由正极流向负极,电子流动方向是由负极流向正极。
③根据原电池里电解质溶液内离子的定向移动方向,在原电池的电解质溶液中,阳离子移向正极,阴离子移向负极。
④根据原电池两级发生的变化来判断,原电池的负极总是失电子发生氧化反应,正极总是得电子发生还原反应。
⑤X极增重或减重:X极质量增加,说明溶液中的阳离子在X极(正极)放电,反之,X极质量减少,说明X极金属溶解,X极为负极。
⑥X极有气泡冒出:发生可析出氢气的反应,说明X极为正极。
⑦X极负极pH变化:析氢或吸氧的电极发生反应后,均能使该电极附近电解质溶液的pH增大,X极附近的pH增大,说明X极为正极。
原电池中的电荷流动:
在外电路(电解质溶液以外),电子(负电荷)由负极经导线(包括电流表和其他用电器)流向正极,使负极呈正电性趋势、正极呈负电性趋势。在内电路(电解质溶液中),阳离子(带正电荷)向正极移动,阴离子 (带负电荷)向负极移动。这样形成了电荷持续定向流动,电性趋向平衡的闭合电路。
精炼铜:
(1)要求
(2)反应原理如下图所示: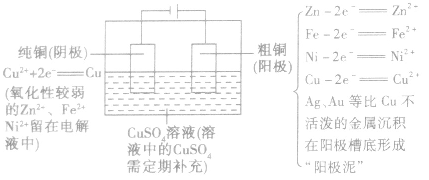
收集方法及装置:
a.排水集气法:适用于收集不溶于水,不与水反应的气体。装置如下:如采用第二个装置,气体应短进长出。

b.向上排空气法:适用于收集密度比空气大不与空气反应的气体,装置如下:如采用第二个装置,气体应长进短出。

c.向下排空气法:适用于收集密度比空气小不与空气反应的气体。装置如下:如采用第二个装置,气体应短进长出。
气体净化:
装置: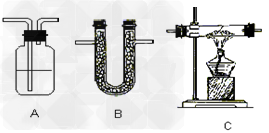

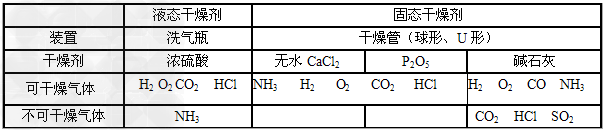
气体干燥:
(1)干燥原则:
干燥剂只能吸收气体中含有的水分而不能与气体发生反应。
①酸性干燥剂不能干燥碱性气体。
②碱性干燥剂不能干燥酸性气体。
③具有强氧化性的干燥剂不能干燥具有强还原性的气体。注意H2、CO、SO2虽具有还原性,但可用浓H2SO4干燥。
(2)常见物质干燥
a.排水集气法:适用于收集不溶于水,不与水反应的气体。装置如下:如采用第二个装置,气体应短进长出。

b.向上排空气法:适用于收集密度比空气大不与空气反应的气体,装置如下:如采用第二个装置,气体应长进短出。

c.向下排空气法:适用于收集密度比空气小不与空气反应的气体。装置如下:如采用第二个装置,气体应短进长出。

气体净化:
装置:


气体干燥:
(1)干燥原则:
干燥剂只能吸收气体中含有的水分而不能与气体发生反应。
①酸性干燥剂不能干燥碱性气体。
②碱性干燥剂不能干燥酸性气体。
③具有强氧化性的干燥剂不能干燥具有强还原性的气体。注意H2、CO、SO2虽具有还原性,但可用浓H2SO4干燥。
(2)常见物质干燥

配置一定物质的量浓度的溶液:
(1)仪器:容量瓶(应注明体积),烧杯,量筒,天平,玻璃棒,滴管
(2)原理:c(浓溶液)V(浓溶液)=c(稀溶液)V(稀溶液)
(3)步骤:
第一步:计算。
第二步:称量:在天平上称量溶质,并将它倒入小烧杯中。
第三步:溶解:在盛有溶质的小烧杯中加入适量蒸馏水,用玻璃棒搅拌,使其溶解。
第四步:移液:将溶液沿玻璃棒注入容量瓶中。
第五步:洗涤:用蒸馏水洗烧杯2~3次,并倒入容量瓶中。
第六步:定容:倒水至刻度线1~2cm处改用胶头滴管滴到与凹液面平直。
第七步:摇匀:盖好瓶塞,上下颠倒、摇匀。
第八步:装瓶、贴签。
(4)误差分析:
①计算是否准确
若计算的溶质质量(或体积)偏大,则所配制的溶液浓度也偏大;反之浓度偏小。
如配制一定浓度的CuSO4溶液,把硫酸铜的质量误认为硫酸铜晶体的质量,导致计算值偏小,造成所配溶液浓度偏小。
②称、量是否无误
如称量NaOH固体在纸上或称量时间过长,会导致NaOH部分潮解甚至变质,有少量NaOH黏附在纸上,造成所配溶液浓度偏低。
量取液体溶质时,俯视或仰视量筒读数,会导致所取溶质的量偏少或偏多,造成所配溶液浓度偏小或偏大。
使用量筒量取液体溶质后再用蒸馏水冲洗量筒,把洗涤液也转入烧杯稀释,或用移液管将液体溶质移入烧杯中后把尖嘴处的残留液也吹入烧杯中。在制造量筒、移液管及滴定管时,已经把仪器内壁或尖嘴处的残留量扣除,所以上述操作均使溶质偏多,造成所配溶液浓度偏大。
③称量时天平未调零
结果不能确定。若此时天平重心偏左,则出称量值偏小,所配溶液的浓度也偏小;若重心偏小,则结果恰好相反。
④称量时托盘天平的砝码生锈
砝码由于生锈而使质量变大,导致称量值偏大,所配溶液的浓度偏高。
⑤操作中溶质有无损失
在溶液配制过程中,若溶质有损失,会使所配溶液浓度偏低。如:⑴溶解(或稀释)溶质,搅拌时有少量液体溅出;⑵未洗涤烧杯或玻璃棒;⑶洗涤液未转入容量瓶;⑷转移洗涤液时有少量液体溅出容量瓶。
影响溶液体积V的操作有:
①定容时不慎加水超过容量瓶的刻度线,再用胶头滴管吸出,使液面重新达到刻度线。当液面超过刻度线时,V偏大使溶液浓度CB已变小,无论是否取出都无法使溶液恢复,只有重新配制。
②定容后盖上瓶塞,摇匀后发现液面低于刻度线,再滴加蒸馏水使液面重新达到刻度线。定容时由于少量溶液粘在瓶颈处没有回流,使液面偏低但溶液浓度未变,若再加水,则使V偏大,cB偏小。
③定容时仰视或俯视
定容时仰视,则液面高于刻度线,V偏大,cB偏小;俯视时液面低于刻度线,V偏小,cB偏大。
④移液或定容时玻璃棒下端放在容量瓶刻度线之上
会导致V偏大,cB偏小。
⑤溶液未冷却至室温即转移入容量瓶
溶解或稀释过程常伴有热效应而使溶液温度升高或降低。容量瓶的使用温度为室温(20℃),若定容时溶液温度高于室温,会使所配溶液浓度偏高;反之浓度偏低。
(1)仪器:容量瓶(应注明体积),烧杯,量筒,天平,玻璃棒,滴管
(2)原理:c(浓溶液)V(浓溶液)=c(稀溶液)V(稀溶液)
(3)步骤:
第一步:计算。
第二步:称量:在天平上称量溶质,并将它倒入小烧杯中。
第三步:溶解:在盛有溶质的小烧杯中加入适量蒸馏水,用玻璃棒搅拌,使其溶解。
第四步:移液:将溶液沿玻璃棒注入容量瓶中。
第五步:洗涤:用蒸馏水洗烧杯2~3次,并倒入容量瓶中。
第六步:定容:倒水至刻度线1~2cm处改用胶头滴管滴到与凹液面平直。
第七步:摇匀:盖好瓶塞,上下颠倒、摇匀。
第八步:装瓶、贴签。
(4)误差分析:
①计算是否准确
若计算的溶质质量(或体积)偏大,则所配制的溶液浓度也偏大;反之浓度偏小。
如配制一定浓度的CuSO4溶液,把硫酸铜的质量误认为硫酸铜晶体的质量,导致计算值偏小,造成所配溶液浓度偏小。
②称、量是否无误
如称量NaOH固体在纸上或称量时间过长,会导致NaOH部分潮解甚至变质,有少量NaOH黏附在纸上,造成所配溶液浓度偏低。
量取液体溶质时,俯视或仰视量筒读数,会导致所取溶质的量偏少或偏多,造成所配溶液浓度偏小或偏大。
使用量筒量取液体溶质后再用蒸馏水冲洗量筒,把洗涤液也转入烧杯稀释,或用移液管将液体溶质移入烧杯中后把尖嘴处的残留液也吹入烧杯中。在制造量筒、移液管及滴定管时,已经把仪器内壁或尖嘴处的残留量扣除,所以上述操作均使溶质偏多,造成所配溶液浓度偏大。
③称量时天平未调零
结果不能确定。若此时天平重心偏左,则出称量值偏小,所配溶液的浓度也偏小;若重心偏小,则结果恰好相反。
④称量时托盘天平的砝码生锈
砝码由于生锈而使质量变大,导致称量值偏大,所配溶液的浓度偏高。
⑤操作中溶质有无损失
在溶液配制过程中,若溶质有损失,会使所配溶液浓度偏低。如:⑴溶解(或稀释)溶质,搅拌时有少量液体溅出;⑵未洗涤烧杯或玻璃棒;⑶洗涤液未转入容量瓶;⑷转移洗涤液时有少量液体溅出容量瓶。
影响溶液体积V的操作有:
①定容时不慎加水超过容量瓶的刻度线,再用胶头滴管吸出,使液面重新达到刻度线。当液面超过刻度线时,V偏大使溶液浓度CB已变小,无论是否取出都无法使溶液恢复,只有重新配制。
②定容后盖上瓶塞,摇匀后发现液面低于刻度线,再滴加蒸馏水使液面重新达到刻度线。定容时由于少量溶液粘在瓶颈处没有回流,使液面偏低但溶液浓度未变,若再加水,则使V偏大,cB偏小。
③定容时仰视或俯视
定容时仰视,则液面高于刻度线,V偏大,cB偏小;俯视时液面低于刻度线,V偏小,cB偏大。
④移液或定容时玻璃棒下端放在容量瓶刻度线之上
会导致V偏大,cB偏小。
⑤溶液未冷却至室温即转移入容量瓶
溶解或稀释过程常伴有热效应而使溶液温度升高或降低。容量瓶的使用温度为室温(20℃),若定容时溶液温度高于室温,会使所配溶液浓度偏高;反之浓度偏低。
发现相似题
与“下列关于各装置图的叙述中,正确的是[ ]A.若采用装置①精炼铜...”考查相似的试题有:
- 锂离子电池已经成为新一代实用化的蓄电池,该电池具有能量密度大、电压高的特性。锂离子电池放电时的电极反应式为负极反应:C...
- 燃料电池是燃料(例如CO,H2,CH4等)跟氧气或空气起反应,将此反应的化学能转变为电能的装置,电解质通常是KOH溶液。下列关...
- 如右图所示装置,若要使装置中电流计的指针发生偏转,则向容器中加入的物质是A.植物油 B.酒精C.蔗糖溶液 D.稀硫酸
- (8分)利用下列反应:Fe+Cu2+===Fe2++Cu设计一个化学电池(给出若干导线和一个小灯泡,电极材料和电解质溶液自选),画出实...
- 按下图装置进行实验,并回答下列问题(1)判断装置的名称:A池为___________ B池为___________(2)铁极为__________极,电极...
- 下列有关锌锰干电池的说法中正确的是( )A.锌外壳是负极,石墨碳棒是正极材料B.在外电路中电子从碳棒流向锌外壳C.电流从...
- (1)氢氧燃料电池以熔融态的碳酸盐为电解质,其中CO2会参与电极反应。工作时负极的电极反应为;正极的电极反应为___________...
- (17分)甲学生急需3.0 mol·L-1稀硫酸做探究性实验,而此时实验室只有18.4 mol·L-1浓硫酸。请你为他配制100 mL 3.0 mol·L-1稀...
- 为达到预期的实验目的,下列操作正确的是( )A.欲配制质量分数为10%的ZnS04溶液,将10gZnS04•7H20溶解在90g水中B.欲制备Fe...
- (Ⅰ)气体制备时须先检查装置的气密性,下列各图所示装置,肯定不符合气密性检查要求的是______.(Ⅱ)下面是中学化学实验中...