本试题 “在苹果、香蕉等水果的果香中存在着乙酸正丁酯,它常用于硝化纤维及漆类的溶剂。某化学课外兴趣小组欲以乙酸和正丁醇为原料合成乙酸正丁酯(Ⅰ)乙酸正丁酯的制...” 主要考查您对酯
其他物质的制备(硫酸铜晶体、铁红等)
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 酯
- 其他物质的制备(硫酸铜晶体、铁红等)
酯类:
1.概念及通式:
酸(羧酸或无机含氧酸)和醇起反应生成的一类化合物叫酯。如:
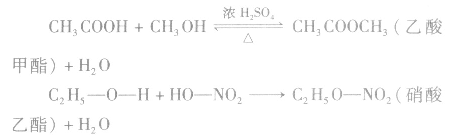
酯的通式为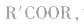 官能团是
官能团是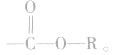 饱和一元羧酸和饱和一元醇形成的酯的通式为
饱和一元羧酸和饱和一元醇形成的酯的通式为 (n≥2),所以这种酯与碳原子数相同的饱和一元羧酸及羟基醛互为同分异构体,与多1个碳原子的饱和一元醇的相对分子质量相等。
(n≥2),所以这种酯与碳原子数相同的饱和一元羧酸及羟基醛互为同分异构体,与多1个碳原子的饱和一元醇的相对分子质量相等。
2.分类
根据生成酯的酸的不同,酯可分为有机酸酯和无机酸酯,通常所说的酯是指有机酸(羧酸)酯。
3.书写及命名——某酸某酯
根据生成酯的酸和醇对酯进行命名:如:

4.酯的存在酯类广泛存在于自然界中,如苹果里含有戊酸戊酯,香蕉里含有乙酸异戊酯等。
1.概念及通式:
酸(羧酸或无机含氧酸)和醇起反应生成的一类化合物叫酯。如:

酯的通式为
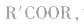 官能团是
官能团是 饱和一元羧酸和饱和一元醇形成的酯的通式为
饱和一元羧酸和饱和一元醇形成的酯的通式为 (n≥2),所以这种酯与碳原子数相同的饱和一元羧酸及羟基醛互为同分异构体,与多1个碳原子的饱和一元醇的相对分子质量相等。
(n≥2),所以这种酯与碳原子数相同的饱和一元羧酸及羟基醛互为同分异构体,与多1个碳原子的饱和一元醇的相对分子质量相等。2.分类
根据生成酯的酸的不同,酯可分为有机酸酯和无机酸酯,通常所说的酯是指有机酸(羧酸)酯。
3.书写及命名——某酸某酯
根据生成酯的酸和醇对酯进行命名:如:


4.酯的存在酯类广泛存在于自然界中,如苹果里含有戊酸戊酯,香蕉里含有乙酸异戊酯等。
酯的性质:
1.酯的物理性质
低级酯是具有芳香气味的液体,密度一般小于水,并难溶于水,易溶于有机溶剂。
2.酯的化学性质
在酸或碱催化的条件下,酯可以发生水解反应,能得到相应的酸和醇。酯在酸性条件下的水解反应是可逆反应。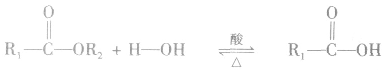
酯在碱性条件下的水解程度大于在酸性条件下的水解程度,其主要原因是在碱性条件下,酯水解生成的羧酸可以与碱发生反应,使羧酸浓度减小,即减小了生成物的浓度,化学平衡向正反应方向移动,使酯的水解程度增大。
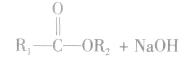
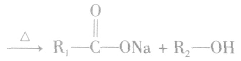
3.酯的用途酯具有广泛的用途。很多香精、药物本身就是酯。例如,广泛用于农业生产和家庭除虫的低毒高效杀虫药拟除虫菊酯就是一种酯,某些抗生素如红霉素为大环内酯类抗生素,也属于酯。日常生活中的饮料、糖果和糕点等常使用酯类物质作为香料。液态的酯可用作有机溶剂。
酯化反应的规律归纳:
1.酯化反应中量的变化
(1)酯化反应发生时,每有1mol酯基“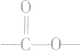 ”生成,必生成1molH2O。根据质量守恒有:反应物巾各元素原子数=生成物中各元素原子数;m(酸)+m(醇)=m(酯)+m(H2O)。
”生成,必生成1molH2O。根据质量守恒有:反应物巾各元素原子数=生成物中各元素原子数;m(酸)+m(醇)=m(酯)+m(H2O)。
2.酯化反应前后碳链结构的变化规律
在下列一系列变化中,分子中的碳链结构不变:醇 醛
醛 羧酸
羧酸 酯,酯键两侧的碳骨架仍保持着醇的碳架和羧酸的碳架。醇与它自身氧化成的羧酸反应生成的酯,酯键两侧碳骨架相同。
酯,酯键两侧的碳骨架仍保持着醇的碳架和羧酸的碳架。醇与它自身氧化成的羧酸反应生成的酯,酯键两侧碳骨架相同。
3.酯化反应的反应条件
酯化反应是可逆反应,逆反应是酯的水解。羧酸和醇的酯化反应速率很慢,冈此,酯化反应通常要在加热并加催化剂(浓硫酸)的条件下进行。之所以用浓硫酸而不用稀硫酸是因为浓硫酸除起催化作用外,还可作吸水剂吸收酯化反应生成的水,有利于反应向生成酯的方向进行。酯化反应巾的浓硫酸,可用浓磷酸
实验室制取甲烷(CH4):
(1)反应原理:CH3COONa+NaOH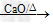 CH4+Na2CO3
CH4+Na2CO3
(2)发生装置:固+固 气
气
(3)净化方法:浓硫酸(除水蒸气)
(4)收集方法:排水集气法/向下排空气法
(5)尾气处理:无
(6)检验方法:①点燃,淡蓝色火焰,燃烧产物是H2O和CO2
实验室制取一氧化氮(NO):
(1)反应原理:3Cu+8HNO3(稀)==3Cu(NO3)2+2NO↑+4H2O
(2)发生装置:固+液→气
(3)净化方法:浓硫酸(除水蒸气)
(4)收集方法:排水集气法
(5)尾气处理:收集法(塑料袋)
(6)检验方法:无色气体,暴露于空气中立即变为红棕色
实验室制取二氧化氮(NO2):
(1)反应原理:Cu+4HNO3(浓)==Cu(NO3)2+2NO2↑+2H2O
(2)发生装置:固+液→气
(3)净化方法:浓硫酸(除水蒸气)
(4)收集方法:向上排空气法
(5)尾气处理:碱液吸收 (3NO2+H2O==2HNO3+NO;NO+NO2+2NaOH===2NaNO2+H2O)
实验室制取氯化氢(HCl):
(1)反应原理:2NaCl+H2SO4 Na2SO4+2HCl?
Na2SO4+2HCl?
(2)发生装置:固+液→气
(3)净化方法:浓硫酸(除水蒸气)
(4)收集方法:向上排空气法
(5)尾气处理:水(防倒吸装置)
(6)检验方法:①能使湿润的蓝色石蕊试纸变红 ②靠近浓氨水冒白烟
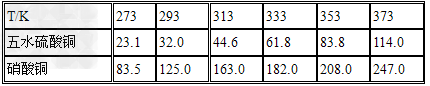
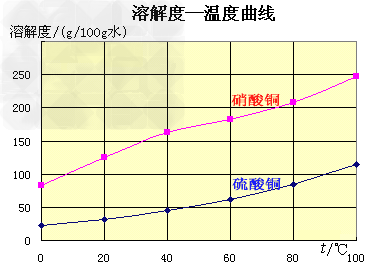
五水硫酸铜的制备:
(1)实验原理:铜是不活泼金属,不能直接和稀硫酸发生反应制备硫酸铜,必须加入氧化剂。在浓硝酸和稀硫酸的混合液中,浓硝酸将铜氧化成Cu2+,Cu2+与SO42-结合得到硫酸铜: Cu+2HNO3+H2SO4====CuSO4+2NO2+2H2O 未反应的铜屑(不溶性杂质)用倾滗法除去。利用硝酸铜的溶解度在0~100℃范围内均大于硫酸铜溶解度的性质,溶液经蒸发浓缩析出硫酸铜,经过滤与可溶性杂质硝酸铜分离,得到粗产品。硫酸铜的溶解度随温度升高而增大,可用重结晶法提纯。在粗产品硫酸铜中,加适量水,加热成饱和溶液,趁热过滤除去不溶性杂质。滤液冷却,析出硫酸铜,过滤,与可溶性杂质分离,得到纯的硫酸铜。
(2)实验步骤
①称量1.5g铜屑,灼烧至表面呈现黑色,冷却;
②加5.5mL3mol/L硫酸,2.5mL浓硝酸,反应平稳后水浴加热,补加2.5mL3mol/L硫酸,0.5mL浓硝酸;
③铜近于完全溶解后,趁热倾滗法分离;
④水浴加热,蒸发浓缩至结晶膜出现;
⑤冷却、过滤;
⑥粗产品以1.2mL水/g的比例,加热溶于水,趁热过滤;
⑦滤液冷却、过滤、晾干,得到纯净的硫酸铜晶体。
⑧称重,计算产率。
实验室制取硫化氢(H2S):
(1)反应原理:FeS+2HCl→H2S↑+FeCl2
(2)发生装置:固+液→气(启普发生器)
(3)净化方法:饱和NaHS(除HCl),固体CaCl2(除水蒸气)
(4)收集方法:向上排空气法
(5)尾气处理:CuSO4溶液或碱液吸收(H2S+2NaOH==Na2S+H2O或H2S+NaOH==NaHS+H2O)
(6)检验方法:①湿润的蓝色石蕊试纸变红 ②湿润的醋酸试纸黑
(1)反应原理:CH3COONa+NaOH
 CH4+Na2CO3
CH4+Na2CO3(2)发生装置:固+固
 气
气 (3)净化方法:浓硫酸(除水蒸气)
(4)收集方法:排水集气法/向下排空气法
(5)尾气处理:无
(6)检验方法:①点燃,淡蓝色火焰,燃烧产物是H2O和CO2
实验室制取一氧化氮(NO):
(1)反应原理:3Cu+8HNO3(稀)==3Cu(NO3)2+2NO↑+4H2O
(2)发生装置:固+液→气
(3)净化方法:浓硫酸(除水蒸气)
(4)收集方法:排水集气法
(5)尾气处理:收集法(塑料袋)
(6)检验方法:无色气体,暴露于空气中立即变为红棕色
实验室制取二氧化氮(NO2):
(1)反应原理:Cu+4HNO3(浓)==Cu(NO3)2+2NO2↑+2H2O
(2)发生装置:固+液→气
(3)净化方法:浓硫酸(除水蒸气)
(4)收集方法:向上排空气法
(5)尾气处理:碱液吸收 (3NO2+H2O==2HNO3+NO;NO+NO2+2NaOH===2NaNO2+H2O)
实验室制取氯化氢(HCl):
(1)反应原理:2NaCl+H2SO4
 Na2SO4+2HCl?
Na2SO4+2HCl?(2)发生装置:固+液→气
(3)净化方法:浓硫酸(除水蒸气)
(4)收集方法:向上排空气法
(5)尾气处理:水(防倒吸装置)
(6)检验方法:①能使湿润的蓝色石蕊试纸变红 ②靠近浓氨水冒白烟
五水硫酸铜的制备:
(1)实验原理:铜是不活泼金属,不能直接和稀硫酸发生反应制备硫酸铜,必须加入氧化剂。在浓硝酸和稀硫酸的混合液中,浓硝酸将铜氧化成Cu2+,Cu2+与SO42-结合得到硫酸铜: Cu+2HNO3+H2SO4====CuSO4+2NO2+2H2O 未反应的铜屑(不溶性杂质)用倾滗法除去。利用硝酸铜的溶解度在0~100℃范围内均大于硫酸铜溶解度的性质,溶液经蒸发浓缩析出硫酸铜,经过滤与可溶性杂质硝酸铜分离,得到粗产品。硫酸铜的溶解度随温度升高而增大,可用重结晶法提纯。在粗产品硫酸铜中,加适量水,加热成饱和溶液,趁热过滤除去不溶性杂质。滤液冷却,析出硫酸铜,过滤,与可溶性杂质分离,得到纯的硫酸铜。


(2)实验步骤
①称量1.5g铜屑,灼烧至表面呈现黑色,冷却;
②加5.5mL3mol/L硫酸,2.5mL浓硝酸,反应平稳后水浴加热,补加2.5mL3mol/L硫酸,0.5mL浓硝酸;
③铜近于完全溶解后,趁热倾滗法分离;
④水浴加热,蒸发浓缩至结晶膜出现;
⑤冷却、过滤;
⑥粗产品以1.2mL水/g的比例,加热溶于水,趁热过滤;
⑦滤液冷却、过滤、晾干,得到纯净的硫酸铜晶体。
⑧称重,计算产率。
实验室制取硫化氢(H2S):
(1)反应原理:FeS+2HCl→H2S↑+FeCl2
(2)发生装置:固+液→气(启普发生器)
(3)净化方法:饱和NaHS(除HCl),固体CaCl2(除水蒸气)
(4)收集方法:向上排空气法
(5)尾气处理:CuSO4溶液或碱液吸收(H2S+2NaOH==Na2S+H2O或H2S+NaOH==NaHS+H2O)
(6)检验方法:①湿润的蓝色石蕊试纸变红 ②湿润的醋酸试纸黑
发现相似题
与“在苹果、香蕉等水果的果香中存在着乙酸正丁酯,它常用于硝化...”考查相似的试题有:
- 某酯分子式为C6H12O2,该酯水解生成A和B,B是A的同分异构体的氧化产物,该酯为( )A.CH3CH(CH3)COOC2H5B.CH3CH2COO(CH2...
- 下列说法不正确的是[ ]A.麦芽糖及其水解产物均能发生银镜反应B.用溴水即可鉴别苯酚溶液、2,4-己二烯和甲苯C.在酸性条件下...
- 用如图装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是 ( ) 气体abCANO2浓硝酸铜片Na...
- (14分)下图为实验室制取纯净、干燥的Cl2,并进行检验Cl2性质实验的装置。其中E瓶中放有干燥红色布条;F中为铜网,F右端出气...
- 可用右图装置制取和收集的气体是A.锌与稀硫酸反应制H2B.浓盐酸与二氧化锰反应制Cl2C.过氧化氢溶液与二氧化锰反应制O2D.电...
- 聚合硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理。现用一定质量的铁的氧化物(如下图)为原料来制取聚...
- 实验室用如图所示的仪器药品制取氯化铁粉末,已知氯化铁粉末很容易吸水生成结晶水化合物FeCl3+6H2O=FeCl3·6H2O,加热时其分解...
- 1-乙氧基萘是一种无色液体,密度比水大,不溶于水,易溶于醇、醚,熔点 5.5℃,沸点267.4℃。1-乙氧基荼常用作香料,也可作为合...
- (本题共12分)我国利用生产磷铵[(NH4)3PO4]排放的废渣磷灰石制取硫酸并联产水泥的技术研究获得成功。已知磷灰石的主要成分是...
- (9分)实验室用Na2SO4·10H2O配制500ml,0.100mol/L的Na2SO4溶液(1)所需主要仪器为:药匙、托盘天平、烧杯、胶头滴管、 、 ...