本试题 “硫酸的消费量常被作为国家工业发展水平的一种标志.工业合成硫酸最重要一步:2SO2(g)+O2(g)⇌2SO3(g)△H<0.在一定条件下,将2mol SO2(g) 和1mol O2(...” 主要考查您对化学平衡的有关计算
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 化学平衡的有关计算
化学平衡计算的一般思路和方法:
有天化学平衡的计算一般涉及各组分的物质的量、浓度、转化率、百分含量,气体混合物的密度、平均摩尔质量、压强等。通常的思路是写出反应方程式,列出相关量(起始量、变化量、平衡量),确定各量之间的火系,列出比例式或等式或依据平衡常数求解,这种思路和方法通常称为“三段式法”、如恒温恒压下的反应mA(g)+nB(g) pC(g)+ qD(g)
pC(g)+ qD(g)
(1)令A、B的起始物质的量分别为amol,bmol 达到平衡后,A的消耗量为m·xmol,容器容积为VL。
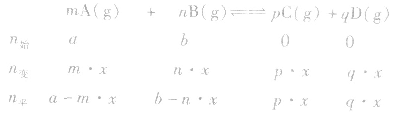
则有:

(2)对于反应物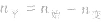 ,对于生成物
,对于生成物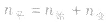
(3)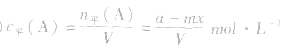
(4)A的转化率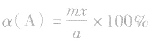
(5)平衡时A的体积(物质的量)分数
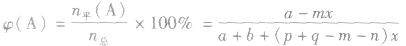
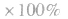
(6)
(7)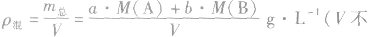
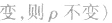
(8)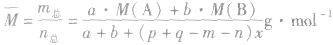
有天化学平衡的计算一般涉及各组分的物质的量、浓度、转化率、百分含量,气体混合物的密度、平均摩尔质量、压强等。通常的思路是写出反应方程式,列出相关量(起始量、变化量、平衡量),确定各量之间的火系,列出比例式或等式或依据平衡常数求解,这种思路和方法通常称为“三段式法”、如恒温恒压下的反应mA(g)+nB(g)
 pC(g)+ qD(g)
pC(g)+ qD(g) (1)令A、B的起始物质的量分别为amol,bmol 达到平衡后,A的消耗量为m·xmol,容器容积为VL。
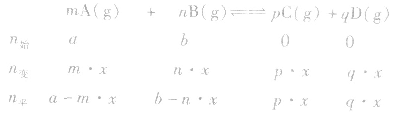
则有:

(2)对于反应物
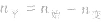 ,对于生成物
,对于生成物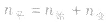
(3)
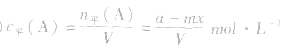
(4)A的转化率
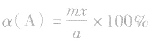
(5)平衡时A的体积(物质的量)分数
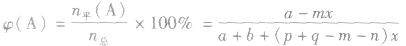
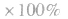
(6)

(7)
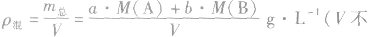
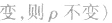
(8)
发现相似题
与“硫酸的消费量常被作为国家工业发展水平的一种标志.工业合成...”考查相似的试题有:
- 一定温度下,可逆反应达到平衡的标志是 ( )A.单位时间内生成n mol A2,同时生成n mol ABB.体系内的总压不随时间变化C.单...
- 下列事实不能用勒夏特列原理解释的是A.温度控制在500℃有利于合成氨反应B.实验室中常用排饱和食盐水的方法收集Cl2C.将相同...
- 在某恒定温度下,向容积为1 L的容器中投入1 mol CO和2 mol H2O,发生如下反应:CO(g)+H2O(g) CO2(g)+H2(g),平衡时生...
- Ⅰ.在一固定容积的密闭容器中进行着如下反应:CO2(g) + H2(g)CO(g) + H2O(g) 其平衡常数K和温度t的关系如下(1)K的表达式为:...
- 在一定温度下将1mol CO和9mol水蒸气放在密闭的容器中发生下列反应:CO(g)+H2O(g)CO2(g)+H2(g)达到平衡后,已知该反应平衡常数...
- 如图:在一个容积固定的反应器中,有一可左右滑动的密封隔板,两侧分别进行如图所示的可逆反应。各物质的起始加入量如下:A、...
- (10分)科学家通过不断地努力,找到了CO合成甲醇的新方法.CO和在443K~473K温度下钴作催化剂,可生成碳原子数为5~8的烷烃...
- (5分)高炉炼铁中发生的基本反应如下:FeO(s)+CO(g)Fe(s)+CO2(g)(正反应为吸热反应),已知1100℃时,该反应的化学平衡常数...
- 将10 mL N2和H2的混合气体在催化剂作用下,500℃左右发生下列可逆反应:N2(g)+3H2(g)2NH3(g), 已知反应达平衡后在相同...
- (4分)在一定温度下,固定容积的2L容器内某一反应中M、N的物质的量浓度随反应时间变化的曲线如图所示:(1)____________时...