本试题 “某同学查阅资料获得有关物质燃烧的信息:2Na+C12 点燃 . 2NaCl 2Mg+CO2 点燃 . 2MgO+C由此形成以下几点认识:①可利用钠与氯气的反应原理生产大量食盐,②镁与...” 主要考查您对置换反应
燃烧与燃烧的条件
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 置换反应
- 燃烧与燃烧的条件
概念:由一种单质和一种化合物反应,生成另一种单质和另一种化合物的反应。
特征:单质+化合物→新单质+新化合物
表达式:A+BC=B+AC
置换反应的规律和发生条件:
特征:单质+化合物→新单质+新化合物
表达式:A+BC=B+AC
置换反应的规律和发生条件:
| 规律 | 发生条件 | 实例 |
| H2+金属氧化物→金属+水 | ①加热 ②K、Ca、Na、Mg、Al等的氧化物除外 |
H2+CuO Cu+H2O Cu+H2O3H2+Fe2O3 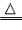 2Fe+3H2O 2Fe+3H2O |
| 碳+金属氧化物→金属+CO2 | ①高温 ②K、Ca、Na、Mg、Al等的氧化物除外 |
C+2CuO 2Cu+CO2↑ 2Cu+CO2↑3C+2Fe2O3  4Fe+3CO2↑ 4Fe+3CO2↑ |
| 金属+酸→盐+氢气 | ①浓硫酸,硝酸具有氧化性,和金属反应不生成氢气; ②在金属活动性顺序中排在氢前面的金属才能置换出酸中的氢 |
Zn+2HCl==ZnCl2+H2↑ Zn+H2SO4(稀)==ZnSO4+H2↑ 2Al+3H2SO4(稀)==Al2(SO4)3+3H2↑ |
| 金属+盐→新盐+新金属 | ①盐必须能溶于水 ②在金属活动性顺序表中,排在前面的金属才能置换出后面的金属 ③钾、钙、钠很活泼,与盐溶液反应不能置换出金属 |
Cu+Hg(NO3)2==Hg+Cu(NO3)2 Fe+CuSO4=FeSO4+Cu |
概念:
燃烧是指可燃物与氧气发生的一种发光放热的剧烈的氧化反应。
燃烧的三个条件:
物质具有可燃性,可燃物与氧气接触,温度达到可燃物的着火点
促进物质燃烧的方法:
(1)增大氧气的浓度
(2)增大可燃物与氧气的接触面积
对燃烧概念的理解:
通常所说的燃烧是一种可燃物与空气中的氧气发生的一种发光、发热的剧烈的氧化反应。但实际上燃烧并不一定有氧气参加,任何发光、发热的剧烈化学反应都可称之为“燃烧”。
如2Mg+CO2
 2MgO+C;2Na+Cl2
2MgO+C;2Na+Cl2 2NaCl
2NaCl燃烧与发光,放热,火焰之间的关系:
(1)燃烧与发光,放热的关系
燃烧一定发光,放热,但发光,放热的变化不一定是化学变化,因而不一定是燃烧,如原子弹,氢弹的爆炸。
(2)燃烧与火焰的关系
火焰是气体物质燃烧所特有的现象、液体物质的燃烧主要是其蒸气的燃烧,因而产生火馅。若固体物质的沸点较高.燃烧时无蒸气逸出,则无火焰,如铁勺燃烧:若固体物质的沸点较低,燃烧时有蒸气逸出,就有火馅,如钠、硫的燃烧。
(3)发光与放热的关系
化学反应瞬间放出热量较多时.就以光的形式出现,反之则不发光,因此,发光一定收热,放热不一定发光。燃烧反应是既发光又放热的反应,单一的发光或放热反应不一定是燃烧。
影响物质着火点的因素:
着火点不是同定不变的。对同体燃料来说,着火点的高低跟表面积的大小、材料的粗细、导热系数的大小有关系。颗粒越细,表而积越大.导热系数越小,着火点越低,所以块状的木材难点燃,向木材的刨花很好点燃。对于液体燃料和气体燃料来说,火焰接触它们的情况和外界压强的大小有关系,所以测定物质的着火点对外界条件有一定标准。
(1)内在因素
可燃物的性质,不同种物质燃烧的现象不同。例如,硫在空气中燃烧发出淡监色火焰,细铁丝在空气中却不能燃烧。
(2)外部因素
①与氧气的接触面积越大,燃烧越剧烈,如煤的燃烧经历了煤块→煤球→蜂窝煤的过程,蜂窝煤能使煤更充分燃烧的原因是与空气的接触面积增大;如俗语说“人要实,火要虚”。
②氧气的浓度越大,燃烧就越剧烈。如硫在空气燃烧发出淡蓝色火焰,而在氧气中燃烧发出蓝紫色火焰。可燃物在纯氧中比在空气中燃烧会更剧烈。
燃烧的利与弊
燃烧会放出入量,人类需要的大部分能量来源于化石燃料的燃烧.人类利用燃烧放出的热量,可以做饭、取暖、发电、冶烁金属等,但燃蛲也有不利的地方,燃料燃烧不充分时,不仅产生的热量少,浪费资源,而且还会产生CO等物质,污染环境
发现相似题
与“某同学查阅资料获得有关物质燃烧的信息:2Na+C12 点燃 . 2NaC...”考查相似的试题有:
- 现有10g铜锌合金,向其中加入足量的硫酸可以生成0.2g氢气,请计算合金中锌的质量分数(写出具体计算过程).
- 在学过化学反应四种基本类型中,一定有单质生成的是______反应,写出该类反应的一个化学方程式______.
- 善于归纳知识,有利于培养素质。下列知识整理的内容不完全正确的一组是[ ]A.化学反应基本类型①化合反应4P+5O22P2O5②分解反应...
- 以下说法正确的是( )A.可燃物只要温度达到着火点或有充足的氧气就可以燃烧B.水溶液是碱性的溶液一定是碱的溶液C.中和反...
- 归纳与反思是学习过程中的重要环节之一.如图所示是教科书的一幅插图,“点燃”两字是某同学做的听课笔计.下列几位同学复习时...
- 节假日去野炊很快乐.然而,在野炊的情趣之中,有下面一些问题,请你帮忙解决.(1)对野炊餐具最好是导热性好,不易破碎的材...
- 阅读材料,回答问题.材料1:某日凌晨,某大厦发生火灾,大火整整持续了近12个小时.据初步调查,造成火灾的起因是工人擅离职...
- 下图四支蜡烛都将熄灭,其中一支熄灭的原因与另外三支不同的是
- 燃烧固体燃料需要架空,燃烧才能更旺。从燃烧的条件看,燃料架空的实质是[ ]A.降低可燃物的着火点B.提高空气中氧气的含量C...
- 科技的不断发展,总是影响产业结构的调整.打火机的出现给人们的生活带来了方便,火柴厂也逐渐淡出人们的视线.如图为普通电...