本试题 “下列物质间的转化能一步实现的是[ ]A. Na2CO3→NaOHB. CaCO3→Ca(OH)2C. NaNO3→NaClD. FeSO4→CuSO4” 主要考查您对碳酸钠
氢氧化钠
硫酸盐
硝酸盐
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 碳酸钠
- 氢氧化钠
- 硫酸盐
- 硝酸盐
碳酸钠(Na2CO3):
(1)俗名:纯碱或苏打;白色粉末,易溶于水,稳定;可用于制玻璃、肥皂、造纸、防治等
(2)与H+反应:CO32-+2H+==CO2↑+H2O
(3)与NaOH不反应
(4)与石灰水反应:CO32-+Ca2+==CaCO3↓
(5)与氯化钡反应:CO32-+Ba2+==BaCO3↓
(6)与CO2反应:CO32-+CO2+H2O==2HCO3-
碳酸钠的物理性质:
碳酸钠常温下为白色粉末或颗粒。溶于水和甘油,不溶于乙醇。水溶液呈强碱性,pH11.6。
碳酸钠是一种强碱盐,溶于水后发生水解反应(碳酸钠水解会产生碳酸氢钠和氢氧化钠),使溶液显碱性,有一定的腐蚀性,能与酸进行复分解反应。
稳定性 稳定性较强,但高温下也可分解,生成氧化钠和二氧化碳。长期暴露在空气中能吸收空气中的水分及二氧化碳,生成碳酸氢钠,并结成硬块。吸湿性很强,很容易结成硬块,在高温下也不分解。含有结晶水的碳酸钠有3种:Na2CO3·H2O、Na2CO3·7H2O和Na2CO3·10H2O。
碳酸钠的用途:
用于制玻璃、肥皂、造纸、纺织等工业,也用作食品工业发酵剂。
Na2CO3、NaHCO3的性质比较:
| 表示 | 名称 | 碳酸钠 | 碳酸氢钠 |
| 化学式 | Na2CO3 | NaHCO3 | |
| 俗称 | 苏打 | 小苏打 | |
| 物理性质 | 色态 | 白色粉末 | 白色晶体 |
| 溶解性 | 易溶于水 | 能溶于水 | |
| 化学性质 | 与盐酸反应 | Na2CO3+2HCl=2NaCl+H2O+CO2↑ | NaHCO3+HCl=NaCl+H2O+CO2↑ |
| 热稳定性 | 很稳定 | 受热分解:2NaHCO3=(加热)=Na2CO3+H2O+CO2↑ | |
| 与NaOH反应 | 不反应 | NaHCO3+NaOH=Na2CO3+H2O | |
| 相互转化 | Na2CO3+H2O+CO2=2NaHCO3 | NaHCO3+NaOH=Na2CO3+H2O 2NaHCO3=(加热)=Na2CO3+H2O+CO2↑ |
Na2CO3、NaHCO3的鉴别:

Na2CO3、NaHCO3与足量盐酸反应的比较:
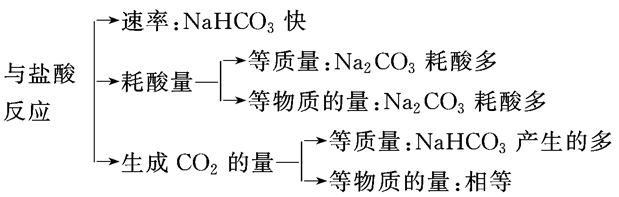
Na2CO3溶液与盐酸反应:
滴加顺序不同,现象不同,化学方程式不同。
①向盐酸里逐滴加入Na2CO3溶液(开始时酸过量) 2HCl+Na2CO3===2NaCl+CO2↑+H2O
②向Na2CO3溶液里逐滴加入盐酸(开始时酸不足) HCl+Na2CO3==NaCl+NaHCO3(无气泡) HCl+NaHCO3==NaCl+CO2↑+H2O(后来有气泡)
[特别提醒]
(1)Na2CO3和盐酸可以用互滴法鉴别。
(2)滴加顺序不同,放出CO2的量可能相同,也可能不同。
碳酸钠、碳酸氢钠与盐酸反应的基本图像的归纳总结:
(1)向Na2CO3中逐滴加入盐酸,消耗HCl的体积与产生CO2的体积的关系如图1所示;
(2)向NaHCO3中逐滴加入盐酸,消耗HCl的体积与产生CO2的体积的关系如图2所示;
(3)向NaOH、Na2CO3的混合物中逐滴加入盐酸,消耗HCl的体积与产生CO2的体积的关系如图3所示(设NaOH、Na2CO3的物质的量之比x∶y=1∶1,其他比例时的图像略);
(4)向Na2CO3、NaHCO3的混合物中逐滴加入盐酸,消耗HCl的体积与产生CO2的体积的关系如图4所示(设Na2CO3、NaHCO3的物质的量之比m∶n=1∶1,其他比例时的图像略)。
氢氧化钠:
俗称火碱、烧碱、苛性钠
(1)与酸反应:NaOH+HCl==NaCl+H2O、2NaOH+H2SO4==Na2SO4+2H2O
(2)与非金属氧化物反应:2NaOH+CO2==Na2CO3+H2O、2NaOH+SO2==Na2SO3+H2O 、2NaOH+SO3==Na2SO4+H2O、2NaOH+SiO2==Na2SiO3+H2O
(3)与盐反应:2NaOH+CuCl2==Cu(OH)2+2NaCl
氢氧化钠的物理性质:
氢氧化钠为白色半透明,结晶状固体。其水溶液有涩味和滑腻感。密度:2.130g/cm3,熔点:318.4℃,沸点:1390℃。
溶解性:极易溶于水,溶解时放出大量的热。易溶于水醇、乙醇以及甘油。(氢氧化钠具有潮解性)
吸湿性:固碱吸湿性很强,露放在空气中,最后会完全溶解成溶液。
氢氧化钠的化学性质:
强碱性:
氢氧化钠溶液是常见的强碱,具有碱的通性:
①使酸碱指示剂变色:能使石蕊溶液变蓝,能使酚酞溶液变红;
②与酸发生中和反应生成盐和水;NaOH+HCl=NaCl+H2O
③与某些盐反应生成新盐和新碱;2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
④与酸性氧化物反应生成盐和水。2NaOH+CO2====Na2CO3+H2O
腐蚀性:
氢氧化钠对玻璃制品有轻微的腐蚀性,两者会生成硅酸钠,使得玻璃仪器中的活塞黏着于仪器上。如果以玻璃容器长时间盛装热的氢氧化钠溶液,会造成玻璃容器损坏。
氢氧化钠溶液与CO2的反应规律:
当二氧化碳少量时:2NaOH+CO2(少量)=Na2CO3+H2O
当二氧化碳过量时:Na2CO3+CO2(过量)+H2O=2NaHCO3
当二氧化碳与氢氧化钠的物质的量之比大于1小于2时,生成碳酸钠与碳酸氢钠的混合物。具体各产物的物质的量可根据钠元素守恒和碳元素守恒求算。
几种重要的硫酸盐:

 的检验:
的检验:
1.SO42-的检验
(1)原理:利用 ,
,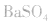 具有不溶于盐酸、硝酸的特性。
具有不溶于盐酸、硝酸的特性。
(2)试剂:可溶性钡盐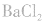 溶液或
溶液或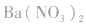 溶液,盐酸和稀硝酸。
溶液,盐酸和稀硝酸。
(3)易出现的错误:
①只加可溶性钡盐,不酸化。误将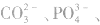 、
、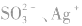 等判成SO42-,此时上述离子会分别产生
等判成SO42-,此时上述离子会分别产生 等白色沉淀.
等白色沉淀.
②先加可溶性盐,后酸化。误将 等判成SO42-,如向待测液中先滴加
等判成SO42-,如向待测液中先滴加 溶液,再加盐酸有白色沉淀生成便断定含SO42-。其错误之处是未注意溶液中不含SO42-而含Ag+或
溶液,再加盐酸有白色沉淀生成便断定含SO42-。其错误之处是未注意溶液中不含SO42-而含Ag+或 也会有同样现象,因为
也会有同样现象,因为
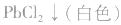
③试剂选择错误。误将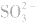 判成
判成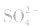 ,如向待测液中滴加盐酸酸化的
,如向待测液中滴加盐酸酸化的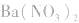 溶液,或滴加硝酸酸化的
溶液,或滴加硝酸酸化的 溶液,生成白色沉淀,使误以为有
溶液,生成白色沉淀,使误以为有 ,错在未注意
,错在未注意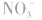 在酸性条件下具有强氧化性,可将
在酸性条件下具有强氧化性,可将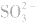 氧化成
氧化成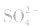 。
。
(4)检验的关键:既要注意试刹的选择,义耍注意操作顺序的优化,全面考虑,综合分析,正确推导,方能排除干扰离子。
(5)最佳检验方法:
2.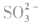 的检验常用气体法:
的检验常用气体法: (不能用硝酸等强氧化性酸),生成能使品红溶液褪色的无色有刺激性气味的气体。
(不能用硝酸等强氧化性酸),生成能使品红溶液褪色的无色有刺激性气味的气体。
3. 的检验
的检验
(1)气体法: ,所用酸必须是非强氧化性酸,可用稀盐酸或稀硫酸,生成能使湿润的醋酸铅试纸变黑的气体。
,所用酸必须是非强氧化性酸,可用稀盐酸或稀硫酸,生成能使湿润的醋酸铅试纸变黑的气体。
(2)沉淀法: ,生成黑色沉淀;或
,生成黑色沉淀;或 ,生成乳白色或黄色沉淀(溶液中)。
,生成乳白色或黄色沉淀(溶液中)。
亚硫酸及亚硫酸盐:
1.亚硫酸溶液中的微粒
SO2与水反应生成亚硫酸,亚硫酸不稳定,易分储成SO2和H2O,因此SO2与H2O的反应是一个可逆反应,用“ ”表示。
”表示。 
在亚硫酸溶液中存在的微粒有(三分子、四离子):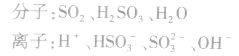
2.亚硫酸的性质
(1)亚硫酸的热稳定性
H2SO3极其不稳定,只能存在于稀的水溶液中。 H2SO3易分解生成SO2和H2O。 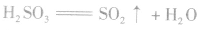
(2)亚硫酸的氧化性和还原性
H2SO3遇到比它更强的氧化剂时,表现还原性。如:
H2SO3遇到比它更强的还原剂时,表现氧化性。如:
(3)亚硫酸的酸性
H2SO3是中强酸,在水溶液中分两步电离: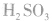
 。
。
由亚硫酸的组成和电离可知,亚硫酸对应的盐有正盐和酸式盐两种,如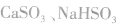 。
。
3.亚硫酸盐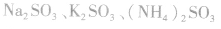 等亚硫酸盐易溶于水、易电离。
等亚硫酸盐易溶于水、易电离。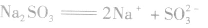

硝酸(HNO3)形成的盐类:
由金属离子(铵离子)和硝酸根离子组成的化合物,重要的有:硝酸钠、硝酸钾、硝酸铵、硝酸钙、硝酸铅、硝酸铈等。
硝酸盐的性质:
(1)物理性质:硝酸盐极易溶于水,大多数硝酸盐为离子型晶体,易溶于水。某些无水盐具有挥发性。易吸湿潮解。不同的硝酸盐又有其各自的特性。
(2)化学性质:
①硝酸盐加热易分解
硝酸盐分解的产物可以是:
亚硝酸盐和氧气(碱金属和碱式金属的硝酸盐);
金属氧化物和氮氧化物(镁和铜之间的硝酸盐);
金属单质(铜后金属硝酸盐)。
硝酸铵的加热分解:
在110°C时: 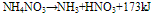
在185~200°C时: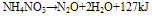
在230°C以上时,同时有弱光: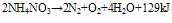
在400°C以上时,发生爆炸: 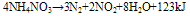
②硝酸盐在高温时是强氧化剂,但水溶液几乎没有氧化作用,但是在酸性环境中有氧化性。 如 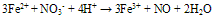
(3)储存:密封阴凉干燥保存。
(4)用途:硝酸盐多用于焰火、试剂、图像处理行业。
与“下列物质间的转化能一步实现的是[ ]A. Na2CO3→NaOHB. CaCO3→C...”考查相似的试题有:
- 不能用来鉴别Na2CO3和NaHCO3两种白色固体的实验操作是[ ]A.分别加热这两种固体物质,并将生成的气体通入澄清的石灰水中B.分别...
- 下列叙述中正确的是[ ]A.向含有CaCO3沉淀的水中通入CO2至沉淀恰好溶解,再向溶液中加入NaHCO3饱和溶液,又有CaCO3沉淀生成B...
- 根据下图所示,选择合适的物质完成图中各步转化。(1)物质X的化学式是___________。(2)①~⑧各步反应的化学方程式。___________...
- 下列装置、操作及说法正确的是( )A.探究NaHCO3的热稳定性B.证明铁生锈与空气有关C.定量测定H2O2的分解速率D.不能证明CH...
- 碳酸钠(Na2CO3)和碳酸氢钠(NaHCO3)都可作为食用碱.(1)用如图装置分别加热上述两种固体,当观察到澄清石灰水变浑浊时,...
- 将等质量的①Na、②Na2O、③Na2O2、④NaOH、⑤Na2CO3·10H2O五种固体物质长时间露置于空气中,固体质量均会发生变化,最后的固体质...
- 在室温时,下列各组中的物质分别与过量NaOH溶液反应,能生成3种盐的一组是[ ]A.SO2、CO2B.C12、A12O3C.CO2、SO3D.SiO2、CO2
- 下列物质:①氢氟酸;②浓H2SO4;③烧碱溶液;④Na2CO3固体;⑤氧化钙;⑥浓HNO3,其中在一定条件下能与SiO2反应的有[ ]A.①②⑥B.全...
- 向各盛有1L水的A.B.C.D 四个烧杯中分别加入等质量的Na、Na2O、Na2O2、NaOH固体,固体完全溶解后,各杯中溶液的质量分数大小顺...
- 硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3、MgO、CaO...