本试题 “某二元酸H2A的电离情况为:H2A=H++HA-;HA-⇌H++A2-.请据此回答下列有关问题:(1)Na2A溶液呈______(填“弱酸性”、“中性”或“弱碱性”),其理由是______(用...” 主要考查您对盐类水解的定义
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 盐类水解的定义
盐类水解:
1.定义:在水溶液中盐电离出来的离子跟水电离出来的H+或OH-结合生成弱电解质的反应,叫做盐类水解。
2.实质:生成弱电解质,使水的电离平衡被破坏而建立新的平衡。
3.条件:盐中必须有弱酸根离子或弱碱阳离子,盐溶于水。
4.特点:可逆性,写水解离子方程式时要用“ ” 水解是吸热过程,是中和反应的逆过程。一般,水解的程度较小,写离子方程式时,不能用“↑”或“↓”符号。多元弱酸根分步水解,以第一步为主。多元弱碱阳离子一步水解。
” 水解是吸热过程,是中和反应的逆过程。一般,水解的程度较小,写离子方程式时,不能用“↑”或“↓”符号。多元弱酸根分步水解,以第一步为主。多元弱碱阳离子一步水解。
5.规律:有弱才水解,无弱不水解。谁弱谁水解,谁强显谁性。越弱越水解,都弱都水解。例如:25℃时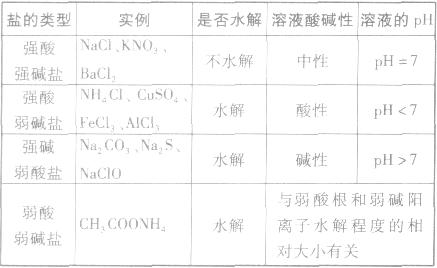
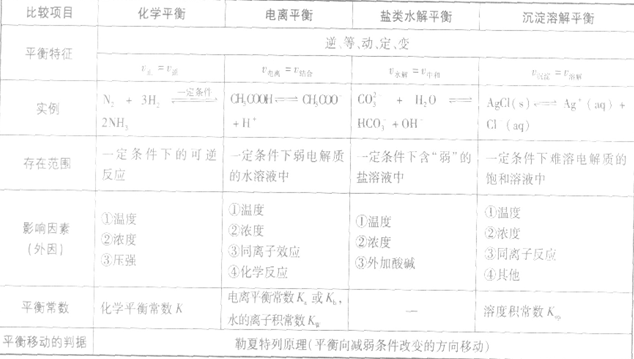
四种重要的动态平衡的比较:
发现相似题
与“某二元酸H2A的电离情况为:H2A=H++HA-;HA-⇌H++A2-.请据此回...”考查相似的试题有:
- 常温下,对pH=10的NaHCO3溶液中,各微粒的物质的量浓度分析正确的是A.c(CO32-)>c(H2CO3)B.c(Na+)>c(HCO3-)>c(H+)>c...
- 关于盐类水解反应的说法正确的是( )A.溶液呈中性的盐一定是强酸与强碱生成的盐B.含有弱酸根离子的盐的水溶液一定呈碱性C....
- 已知某溶液中存在四种离子,其浓度大小有如下关系①②③④其中正确的是 ( )A.①②③B.①②④C.①③④D.②③④
- (15分)锗及其某些化合物是导弹火箭制导中的重要光电材料,工业上生产锗的流程如下:已知:GeO2与浓盐酸反应生成四氯化锗(...
- 室温时,向20mL 0.1mol·L-1的醋酸溶液中不断滴人0.1mol·L-1的NaOH溶液,溶液的pH变化曲线如图所示。在滴定过程中,关于溶液...
- 根据化学平衡知识,判断下列说法正确的是( )A.已知NaHA溶液呈弱碱性,则该溶液中下列各种微粒浓度大小排列顺序为:c(Na+)...
- 下列判断正确的是( )A.已知HClO、HNO2电离常数Ka分别为3.0×10-8、4.6×10-4,0.1mol/L的次氯酸钠溶液的pH小于0.1 mol/L的亚...
- Na2S溶液中各种离子的物质的量浓度关系不正确的是( )A.c(Na+)>c(S2-)>c(OH-)>c(HS-)B.c(Na+)+c(H+)=c(HS-)+2c(S2-)+c(...
- 下列离子方程式正确的是( )A.氯化铝溶液与氨水反应:Al3++3NH3·H2O====Al(OH)3↓+3B.磷酸二氢钙溶液跟足量的氢氧化钠溶液混...
- Na2S溶液中存在多种微粒,下列各微粒间的关系正确的是 ( )A.c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+)B.c(Na+)+c(H...