本试题 “某同学用下列装置制备并检验Cl2的性质。(1)Ⅰ图圆底烧瓶中反应的化学方程式为________________。(2)Ⅱ图中退色的是A____(填“a”或“b”),Ⅱ图烧杯中发生反应的离子...” 主要考查您对氯气
氯气的制取
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 氯气
- 氯气的制取
氯气:
①化学式:Cl2
②氯元素在周期表中的位置:第三周期ⅦA族
③氯原子的电子式: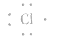
④氯的原子结构示意图: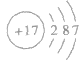
⑤氯原子的外围电子排布式:
⑥化学键类型:非极性共价键
⑦氯分子的电子式:
⑧氯分子的结构式:
氯气的物理性质和化学性质:
(1)物理性质:黄绿色,有刺激性气味,有毒,密度比空气大,能溶于水(1:2)。
(2)化学性质:氯气(Cl2)是双原子分子,原子的最外层有七个电子,是典型的非金属元素,单质是强氧化剂。
①氯气与金属反应: 2Na+Cl2
 2NaCl(反应剧烈,产生大量白烟) 2Fe+3Cl2
2NaCl(反应剧烈,产生大量白烟) 2Fe+3Cl2 2FeCl3(反应剧烈,产生大量棕褐色烟,溶于水成黄色溶液) Cu+Cl2
2FeCl3(反应剧烈,产生大量棕褐色烟,溶于水成黄色溶液) Cu+Cl2 CuCl2(反应剧烈,产生大量棕色的烟,溶于水成蓝色或绿色溶液)氯气能与绝大数金属都能发生反应,表明氯气是一种活泼的非金属单质。
CuCl2(反应剧烈,产生大量棕色的烟,溶于水成蓝色或绿色溶液)氯气能与绝大数金属都能发生反应,表明氯气是一种活泼的非金属单质。 ②与非金属的反应 H2+Cl2
 2HCl(纯净的氢气在氯气中安静的燃烧,芒白色火焰,在瓶口处有白雾产生)H2+Cl2
2HCl(纯净的氢气在氯气中安静的燃烧,芒白色火焰,在瓶口处有白雾产生)H2+Cl2 2HCl(发生爆炸) 2P+3Cl2
2HCl(发生爆炸) 2P+3Cl2 2PCl3(液态) PCl3+Cl2==PCl5(固态)磷在氯气中剧烈燃烧,产生大量的烟、雾。雾是PCl3,烟是PCl5。氯气能有很多非金属单质反应,如S、C、Si等。
2PCl3(液态) PCl3+Cl2==PCl5(固态)磷在氯气中剧烈燃烧,产生大量的烟、雾。雾是PCl3,烟是PCl5。氯气能有很多非金属单质反应,如S、C、Si等。 ③与碱反应 Cl2+2NaOH==NaCl+NaClO+H2O 2Cl2+2Ca(OH)2==CaCl2+Ca(ClO)2+2H2O
④与某些还原性物质反应:Cl2+2FeCl2===2FeCl3 Cl2+SO2+2H2O==2HCl+H2SO4
⑤有机反应(参与有机反应的取代和加成反应)
CH4+Cl2→CH3Cl+HCl
CH3Cl+Cl2→CH2Cl2+HCl
CH2Cl2+Cl2→CHCl3+HCl
CHCl3+Cl2→CCl4+HCl
Cl2+CH2=CH2→CH2Cl-CH2Cl(加成反应)
⑥与水反应 Cl2+H2O
 HCl+HClO
HCl+HClO 氯气的实验室制法:
(1)实验室用浓盐酸和二氧化锰反应制取氯气。 
(2)装置图: 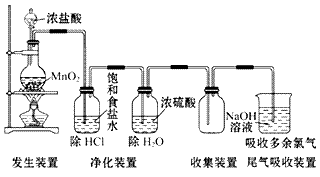
(3) 步骤: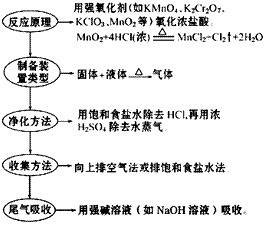

氯气的工业制法:
(1)电解饱和食盐水(氯碱工业),化学方程式为: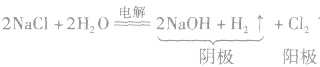
(2)电解熔融的氯化钠(可制得金属蚋),化学方程式为:
(3)电解熔融的氯化镁(可制得金属镁),化学方程式为:
发现相似题
与“某同学用下列装置制备并检验Cl2的性质。(1)Ⅰ图圆底烧瓶中反应...”考查相似的试题有:
- 下列关于卤素的叙述中正确的是[ ]①卤素的钾盐中,最易被氧化是氟化钾;②溴中溶有少量氯气,可以用加入溴化钠再用汽油萃取的方...
- 高锰酸钾是一种典型的强氧化剂,无论在实验室还是在化工生产中都有重要的应用。下图是实验室制备氯气并进行一系列相关实验的...
- 将足量的SO2通入下列各溶液中,所含离子还能大量共存的是A.K+、SiO32-、Cl-、NO3-B.H+、NH4+、Al3+、SO42-C.Na+、Cl...
- 下列物质中,不能使品红溶液褪色的是( )A.Cl2B.HClC.SO2D.活性炭
- 下列说法正确的是( )A.氯气具有漂白性,所以可用氯气漂白织物B.氧化钠和过氧化钠都是氧化物,所以都是酸性氧化物C.将过...
- 关于氯的叙述中,下列正确的是[ ]A.氯气是一种黄绿色、有毒的气体B.氯元素在自然界中既可以以化合态存在,也可以以游离态存...
- 在实验室贮存少量液溴时,需要在瓶中加一些水,其作用是A.稀释,防止溴腐蚀玻璃B.液封,防止溴挥发C.隔绝空气,防止溴被氧...
- 自来水常用Cl2消毒,某学生用这种自来水去配制下列物质的溶液,不会产生明显的药品变质问题的是A.AgNO3B.FeCl2C.Na2SO3D....
- 在通常状况下呈黄绿色的气体是( )A.N2B.H2C.Cl2D.CO2
- 配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏高的原因可能是:A.所用NaOH已潮解B.向容量瓶加水时液面低于刻度线...