本试题 “下列装置所示的实验中,能达到实验目的是( )A.除去Cl2中的HCl杂质B.实验室制取NH3C.定量测定H2O2分解化学反应速率D.c为粗铜,d为纯铜,溶液为硫酸铜溶...” 主要考查您对原电池原理
电解池原理
气体的收集、净化、干燥
化学科学探究
通过实验装置图判断实验的可行性
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 原电池原理
- 电解池原理
- 气体的收集、净化、干燥
- 化学科学探究
- 通过实验装置图判断实验的可行性
原电池:
1.定义:将化学能转化为电能的装置。
2.工作原理:
以铜-锌原电池为例
(1)装置图:
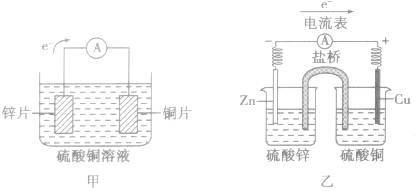
(2)原理图:
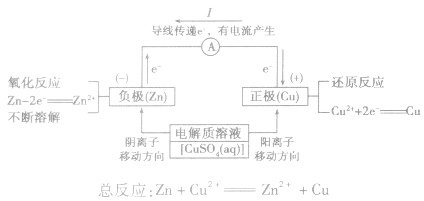
3.实质:化学能转化为电能。
4.构成前提:能自发地发生氧化还原反应。
5.电极反应:
负极:失去电子;氧化反应;流出电子
正极:得到电子;氧化反应;流入电子
6.原电池正负极判断的方法:
①由组成原电池的两级材料判断,一般是活泼金属为负极,活泼性较弱的金属或能导电的非金属为正极。
②根据电流方向或电子流动方向判断,电流是由正极流向负极,电子流动方向是由负极流向正极。
③根据原电池里电解质溶液内离子的定向移动方向,在原电池的电解质溶液中,阳离子移向正极,阴离子移向负极。
④根据原电池两级发生的变化来判断,原电池的负极总是失电子发生氧化反应,正极总是得电子发生还原反应。
⑤X极增重或减重:X极质量增加,说明溶液中的阳离子在X极(正极)放电,反之,X极质量减少,说明X极金属溶解,X极为负极。
⑥X极有气泡冒出:发生可析出氢气的反应,说明X极为正极。
⑦X极负极pH变化:析氢或吸氧的电极发生反应后,均能使该电极附近电解质溶液的pH增大,X极附近的pH增大,说明X极为正极。
1.定义:将化学能转化为电能的装置。
2.工作原理:
以铜-锌原电池为例

(1)装置图:

(2)原理图:

3.实质:化学能转化为电能。
4.构成前提:能自发地发生氧化还原反应。
5.电极反应:
负极:失去电子;氧化反应;流出电子
正极:得到电子;氧化反应;流入电子
6.原电池正负极判断的方法:
①由组成原电池的两级材料判断,一般是活泼金属为负极,活泼性较弱的金属或能导电的非金属为正极。
②根据电流方向或电子流动方向判断,电流是由正极流向负极,电子流动方向是由负极流向正极。
③根据原电池里电解质溶液内离子的定向移动方向,在原电池的电解质溶液中,阳离子移向正极,阴离子移向负极。
④根据原电池两级发生的变化来判断,原电池的负极总是失电子发生氧化反应,正极总是得电子发生还原反应。
⑤X极增重或减重:X极质量增加,说明溶液中的阳离子在X极(正极)放电,反之,X极质量减少,说明X极金属溶解,X极为负极。
⑥X极有气泡冒出:发生可析出氢气的反应,说明X极为正极。
⑦X极负极pH变化:析氢或吸氧的电极发生反应后,均能使该电极附近电解质溶液的pH增大,X极附近的pH增大,说明X极为正极。
原电池中的电荷流动:
在外电路(电解质溶液以外),电子(负电荷)由负极经导线(包括电流表和其他用电器)流向正极,使负极呈正电性趋势、正极呈负电性趋势。在内电路(电解质溶液中),阳离子(带正电荷)向正极移动,阴离子 (带负电荷)向负极移动。这样形成了电荷持续定向流动,电性趋向平衡的闭合电路。
电解池:
(1)电解:使电流通过电解质溶液且在阴、阳极两极引起氧化还原反应的过程叫电解。
(2)装置:电解池(电解槽)
(3)特点:将电能转化为化学能。
形成条件:①与电源相连的两个电极,②电解质溶液或熔融电解质,③形成闭合回路
(4)阴离子放电顺序:S2->I->Br->Cl->OH->SO42->NO3->F- 阳离子放电顺序:Ag+>Hg2+>Fe3+>Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+>Al3+>Mg2+>Na+>Ca2+>K+
(5)电解时溶液pH值的变化规律电解质溶液在电解过程中,有时溶液pH值会发生变化。判断电解质溶液的pH值变化,有时可以从电解产物上去看。
①若电解时阴极上产生H2(消耗H+),阳极上无O2产生,电解后溶液pH值增大;
②若阴极上无H2,阳极上产生O2,则电解后溶液pH值减小;
③若阴极上有H2,阳极上有O2,且(相当于电解水),则有三种情况:
a如果原溶液为中性溶液,则电解后pH值不变;
b如果原溶液是酸溶液,则pH值变小;
c如果原溶液为碱溶液,则pH值变大;
④若阴极上无H2,阳极上无O2产生,电解后溶液的pH可能也会发生变化。如电解CuCl2溶液(CuCl2溶液由于Cu2+水解显酸性),一旦CuCl2全部电解完,pH值会变大,成中性溶液。
(6)电解反应类型:从参加反应的物质来分电解反应可分成五类:
①H2O型:实质是电解水。如电解硝酸钠、氢氧化钠、硫酸等溶液。
②溶质型:溶质所电离出来的离子发生氧化还原,如电解氯化铜、溴化氢等溶液。
③硫酸铜溶液型:电解产物是金属、氧气与酸。如电解硫酸铜溶液生成单质铜、氧气和硫酸,电解硝酸银溶液时生成单质银、氧气和硝酸。
④氯化钠溶液型:电解产物是非金属单质、氢气与碱。如电解氯化钠溶液时生成氯气、氢气和氢氧化钠,电解溴化钾溶液时生成溴单质、氢气和氢氧化钾。
⑤电镀型:镀层金属作阳极,阳极反应是:M-ne-=Mn+,镀件作阴极,阴极反应是:Mn++ne-=M。(电解精炼与电镀,实质上是相同的)
(1)电解:使电流通过电解质溶液且在阴、阳极两极引起氧化还原反应的过程叫电解。
(2)装置:电解池(电解槽)
(3)特点:将电能转化为化学能。
形成条件:①与电源相连的两个电极,②电解质溶液或熔融电解质,③形成闭合回路
(4)阴离子放电顺序:S2->I->Br->Cl->OH->SO42->NO3->F- 阳离子放电顺序:Ag+>Hg2+>Fe3+>Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+>Al3+>Mg2+>Na+>Ca2+>K+
(5)电解时溶液pH值的变化规律电解质溶液在电解过程中,有时溶液pH值会发生变化。判断电解质溶液的pH值变化,有时可以从电解产物上去看。
①若电解时阴极上产生H2(消耗H+),阳极上无O2产生,电解后溶液pH值增大;
②若阴极上无H2,阳极上产生O2,则电解后溶液pH值减小;
③若阴极上有H2,阳极上有O2,且(相当于电解水),则有三种情况:
a如果原溶液为中性溶液,则电解后pH值不变;
b如果原溶液是酸溶液,则pH值变小;
c如果原溶液为碱溶液,则pH值变大;
④若阴极上无H2,阳极上无O2产生,电解后溶液的pH可能也会发生变化。如电解CuCl2溶液(CuCl2溶液由于Cu2+水解显酸性),一旦CuCl2全部电解完,pH值会变大,成中性溶液。
(6)电解反应类型:从参加反应的物质来分电解反应可分成五类:
①H2O型:实质是电解水。如电解硝酸钠、氢氧化钠、硫酸等溶液。
②溶质型:溶质所电离出来的离子发生氧化还原,如电解氯化铜、溴化氢等溶液。
③硫酸铜溶液型:电解产物是金属、氧气与酸。如电解硫酸铜溶液生成单质铜、氧气和硫酸,电解硝酸银溶液时生成单质银、氧气和硝酸。
④氯化钠溶液型:电解产物是非金属单质、氢气与碱。如电解氯化钠溶液时生成氯气、氢气和氢氧化钠,电解溴化钾溶液时生成溴单质、氢气和氢氧化钾。
⑤电镀型:镀层金属作阳极,阳极反应是:M-ne-=Mn+,镀件作阴极,阴极反应是:Mn++ne-=M。(电解精炼与电镀,实质上是相同的)
原电池、电解池、电镀池的比较:


收集方法及装置:
a.排水集气法:适用于收集不溶于水,不与水反应的气体。装置如下:如采用第二个装置,气体应短进长出。

b.向上排空气法:适用于收集密度比空气大不与空气反应的气体,装置如下:如采用第二个装置,气体应长进短出。

c.向下排空气法:适用于收集密度比空气小不与空气反应的气体。装置如下:如采用第二个装置,气体应短进长出。
气体净化:
装置:

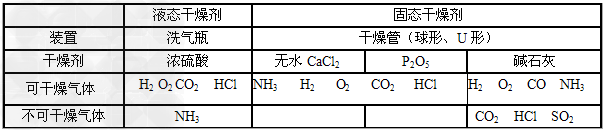
气体干燥:
(1)干燥原则:
干燥剂只能吸收气体中含有的水分而不能与气体发生反应。
①酸性干燥剂不能干燥碱性气体。
②碱性干燥剂不能干燥酸性气体。
③具有强氧化性的干燥剂不能干燥具有强还原性的气体。注意H2、CO、SO2虽具有还原性,但可用浓H2SO4干燥。
(2)常见物质干燥
a.排水集气法:适用于收集不溶于水,不与水反应的气体。装置如下:如采用第二个装置,气体应短进长出。

b.向上排空气法:适用于收集密度比空气大不与空气反应的气体,装置如下:如采用第二个装置,气体应长进短出。

c.向下排空气法:适用于收集密度比空气小不与空气反应的气体。装置如下:如采用第二个装置,气体应短进长出。

气体净化:
装置:


气体干燥:
(1)干燥原则:
干燥剂只能吸收气体中含有的水分而不能与气体发生反应。
①酸性干燥剂不能干燥碱性气体。
②碱性干燥剂不能干燥酸性气体。
③具有强氧化性的干燥剂不能干燥具有强还原性的气体。注意H2、CO、SO2虽具有还原性,但可用浓H2SO4干燥。
(2)常见物质干燥

化学科学探究:
四个环节:查阅资料、提出假设、实验探究、结论分析
提出问题→猜想假设→制定计划→进行实验→收集证据→解释与结论→反思与评价 →表达与交流
四个环节:查阅资料、提出假设、实验探究、结论分析
提出问题→猜想假设→制定计划→进行实验→收集证据→解释与结论→反思与评价 →表达与交流
通过实验装置图判断实验的可行性:
1.红磷转换成白磷装置图
2.氨气易溶于水(喷泉实验)

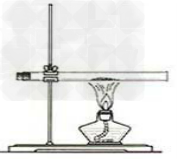
3.氯化铵受热分解
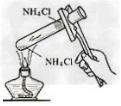
4.铵盐与碱反应
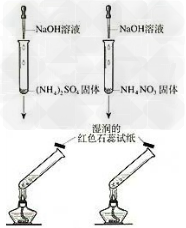
5.实验室制取氨气装置图

6.铝热反应实验装置
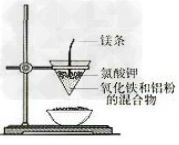
7.铁与水蒸气反应实验装置图

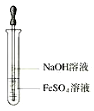
8.氢氧化亚铁的生成
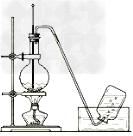
9.实验室制取乙烯的装置图
10.乙烯使高锰酸钾、溴水褪色

11.乙炔的制取和燃烧
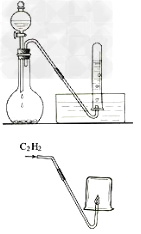
12.乙炔使溴水褪色
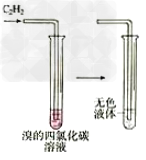
13.苯不能使高锰酸钾褪色

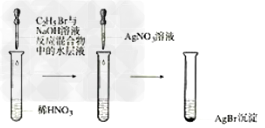
14.溴乙烷的水解反应
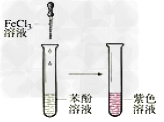
15.苯酚的显色反应
16.乙酸乙酯的制备

17.油脂的水解
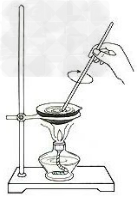
18.中和热的测定
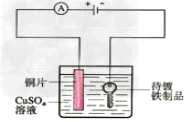
19.电镀铜实验装置
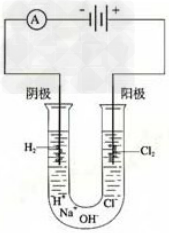
20.点解饱和食盐水
1.红磷转换成白磷装置图

2.氨气易溶于水(喷泉实验)

3.氯化铵受热分解

4.铵盐与碱反应

5.实验室制取氨气装置图

6.铝热反应实验装置

7.铁与水蒸气反应实验装置图

8.氢氧化亚铁的生成

9.实验室制取乙烯的装置图

10.乙烯使高锰酸钾、溴水褪色

11.乙炔的制取和燃烧

12.乙炔使溴水褪色

13.苯不能使高锰酸钾褪色

14.溴乙烷的水解反应

15.苯酚的显色反应

16.乙酸乙酯的制备

17.油脂的水解

18.中和热的测定

19.电镀铜实验装置

20.点解饱和食盐水

发现相似题
与“下列装置所示的实验中,能达到实验目的是( )A.除去Cl2中的...”考查相似的试题有:
- 下列关于图象及描述说法都正确的是[ ]A. 图①铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4B. 图②能组成Zn-Cu原电池C. 图③在电解NaC...
- 硫-碘循环分解水制氢主要涉及下列反应:Ⅰ.SO2+2H2O+I2=H2SO4+2HI Ⅱ. 2HIH2+I2(g) Ⅲ. 2H2SO4=2SO2+O2+2H2O(1)分析...
- (10分)A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。(1)A中反应的离子方程式为 。(2)B中Sn极的电极反应式为 ,...
- 如图为一原电池装置,下列叙述中正确的是( )A.铜是阳极,铜片上有气泡产生B.盐桥中的K+移向ZnSO4溶液C.电流从锌片经导线...
- (12分)铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。(1)写出FeCl3溶液腐蚀印刷电路...
- 如图,一种微型钮扣电池,其电极材料分别为Ag2O和Zn,电解质溶液是KOH溶液。该电池负极的反应式:Zn -2e-+ 2OH-=ZnO+ H2O,总...
- 图1是在金属锌板上贴上一张用某溶液浸湿的滤纸,图2是新型氢氧燃料电池,则下列说法中不正确的是( )A.图2电池放电过程中,...
- 电解硫酸钠溶液联合生产硫酸和烧碱溶液的装置如下图所示,其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体...
- 如图装置,将溶液A逐滴加入固体B中,下列叙述中不正确的是A.若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液不褪色B.若A为...
- (12分)在花瓶中加入“鲜花保鲜剂”,能延长鲜花的寿命。下表是1L“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:成分质量(g...