本试题 “下列说法正确的是( )①正常雨水的pH为7.0;酸雨的pH小于7.0②严格执行机动车尾气排放标准有利于防止大气污染③三大营养素糖类、油脂、蛋白质中,油脂是热能最...” 主要考查您对胶体
三氧化硫
盐类水解判断溶液酸碱性或比较溶液pH值的大小
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 胶体
- 三氧化硫
- 盐类水解判断溶液酸碱性或比较溶液pH值的大小
胶体:分散质粒子直径在10-9m~10-7m之间的分散系胶粒直径的大小是胶体的本质特征
胶体可分为固溶胶、液溶胶、气溶胶
①常见的液溶胶:Fe(OH)3、AgI、牛奶、豆浆、粥等
②常见的气溶胶:雾、云、烟等;
③常见的固溶胶:有色玻璃、烟水晶等胶体的性质:
丁达尔效应:
①当光束通过氢氧化铁胶体时,可以看到一条光亮的通路,这条光亮的通路是由于胶体粒子对光线散射(光波偏离原来方向而分散传播)形成的,即为丁达尔效应。
②布朗运动:粒子在不停地、无秩序的运动
③电泳:胶体粒子带有电荷,在电场的作用下,胶体粒子在分散剂里定向移动。一般来讲:金属氢氧化物,金属氧化物的胶粒吸附阳离子,胶体微粒带正电荷;非金属氧化物,金属硫化物的胶体胶粒吸附阴离子,胶体微粒带负电荷。
④胶体聚沉:向胶体中加入少量电解质溶液时,由于加入的阳离子(或阴离子)中和了胶体粒子所带的电荷,使胶体粒子聚集成为较大的颗粒,从而形成沉淀从分散剂里析出。该过程不可逆。
胶体的特性:
(1)丁达尔效应当一束光通过胶体时,胶体内会出现一条光亮的通路,这是由胶体粒子对光线散射而形成的,利用丁达尔效应可区分胶体和浊液。
(2)介稳性:胶体的稳定性介于溶液和浊液之间,在一定条件下能稳定存在,但改变条件就有可能发生聚沉。
(3)聚沉:给胶体加热、加入电解质或加入带相反电荷的胶体颗粒等均能使胶体粒子聚集成较大颗粒,从而形成沉淀从分散剂里析出。聚沉常用来解释生活常识,如长江三角洲的形成、明矾净水等。
(4)电泳现象:在电场作用下,胶体粒子在分散剂中作定向移动。电泳现象说明胶体粒子带电。电泳常用来分离提纯胶体,如工业上静电除尘。
分散系比较:
| 分散系 | 溶液 | 胶体 | 悬浊液 | 乳浊液 |
| 分散质粒子大小 | <1nm | 1~100nm | >100nm | >100nm |
| 分散质粒子结构 | 分子、离子 | 少量分子的结合体或大分子 | 大量分子聚集成的固体小颗粒 | 大量分子聚集成的液体小液滴 |
| 特点 | 均一、透明、稳定 | 多数均一、透明、较稳定 | 不均一、不透明、久置沉淀 | 不均一、不透明、久置分层 |
| 能否透过滤纸 | 能 | 能 | 不能 | —— |
| 实例 | 食盐水、蔗糖溶液 | Fe(OH)3(胶体)、淀粉胶体 | 泥水、石灰乳 | 牛奶、油漆 |
胶体发生聚沉的条件:
因胶粒带电,故在一定条件下可以发生聚沉:
- 向胶体中滴加电解质
- 向胶体中加入带相反电荷胶粒的胶体
- 加热
常见的胶体的带电情况:
- 胶粒带正电荷的胶体有:金属氧化物、金属氢氧化物。例如Fe(OH)3、Al(OH)3等。
- 胶粒带负电荷的胶体有:非金属氧化物、金属硫化物、硅酸胶体、土壤胶体。
- 胶粒不带电的胶体有:淀粉胶体。
- 特殊的,AgI胶粒随着AgNO3和KI相对量不同,而带正电或负电。若KI过量,则AgI胶粒吸附较多I-而带负电;若AgNO3过量,则因吸附较多Ag+而带正电。
注意:胶体不带电,而胶粒可以带电。
Fe(OH)3胶体的制备:
操作步骤:将烧杯中的蒸馏水加热至沸腾,向沸水中滴加5~6滴饱和FeCl3溶液,继续煮沸至呈红褐色为止。
离子方程式:Fe3++3H2O=(加热)=Fe(OH)3(胶体)+3H+
点拨:(1)淀粉溶液、蛋白质溶液虽叫做溶液,但属于胶体。
(2)胶体可以是液体,也可以是固体、气体,如烟、云、雾、有色玻璃等。
三氧化硫:
分子式:SO3,是含极性键的非极性分子,固态时为分子晶体。
三氧化硫的物理性质和化学性质:
1.物理性质:无色易挥发的晶体,熔点为16.8℃,沸点为44.8℃,易升华。
2.化学性质:SO3表现出酸性氧化物的通性。
(1)与水反应: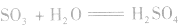 ,SO3遇水剧烈反应生成硫酸,同时放出大量的热,三氧化硫是硫酸的酸酐,又叫硫酐。
,SO3遇水剧烈反应生成硫酸,同时放出大量的热,三氧化硫是硫酸的酸酐,又叫硫酐。
(2)与碱反应:

(3)与碱性氧化物反应:
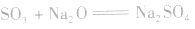
3.SO3的制法:
(1)盐水解的规律:
①谁弱谁水解,谁强显谁性,越弱越水解,都弱都水解,无弱不水解
②多元弱酸根、正酸根离子比酸式酸根离子水解程度大得多,故可只考虑第一步水解
(2)具体分析一下几种情况:
①强碱弱酸的正盐:弱酸的阴离子发生水解,水解显碱性;如:Na2CO3、NaAc等
②强酸弱碱的正盐:弱碱的阳离子发生水解,水解显酸性;如:NH4Cl、FeCl3、CuCl2等;
③强酸强碱的正盐,不发生水解;如:Na2SO4、NaCl、KNO3等;
④弱酸弱碱的正盐:弱酸的阴离子和弱碱的阳离子都发生水解,溶液的酸碱性取决于弱酸和弱碱的相对强弱,谁强显谁性;
⑤强酸的酸式盐只电离不水解,溶液显酸性,如:NaHSO4;而弱酸的酸式盐,既电离又水解,此时必须考虑其电离和水解程度的相对大小:若电离程度大于水解程度,则溶液显酸性,如:NaHSO3、NaH2PO4;若水解程度大于电离程度,则溶液显碱性,如:NaHCO3、NaHS、Na2HPO4等。
(3)几种盐溶液pH大小的比较强酸强碱盐pH=7、强碱弱酸盐pH>7、强酸弱碱盐pH<7
根据其相应的酸的酸性大小来比较,盐溶液对应的酸的酸性越强,其盐溶液的pH越小如:HClO酸性小于H2CO3,溶液pH NaClO>Na2CO3
酸式盐溶液酸碱性的判断:
酸式盐的水溶液显什么性,要看该盐的组成微粒。
1.强酸的酸式盐只电离,不水解,溶液一定显酸性。如 溶液:
溶液: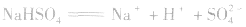
2.弱酸的酸式盐溶液的酸碱性,取决于酸式酸根离子的电离程度和水解程度的相对大小。
(1)若电离程度小于水解程度,溶液显碱性。例如 溶液中:
溶液中: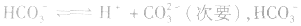
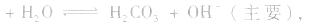
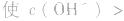
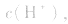 溶液显碱性。NaHS溶液、Na2HPO4溶液亦显碱性
溶液显碱性。NaHS溶液、Na2HPO4溶液亦显碱性
(2)若电离程度大于水解程度,溶液显酸性。例如 溶液中:
溶液中: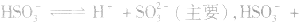
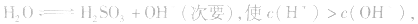 溶液显酸性
溶液显酸性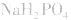 溶液亦显酸性。
溶液亦显酸性。
盐溶液蒸干后所得物质的判断:
1.考虑盐是否分解。如加热蒸干 溶液,因
溶液,因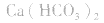 分解,所得固体应是
分解,所得固体应是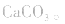
2.考虑氧化还原反应。如加热蒸干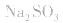 溶液,因
溶液,因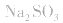 易被氧化,所得固体应是
易被氧化,所得固体应是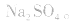
3.盐水解生成挥发性酸时,蒸干后一般得到弱碱,如蒸干 溶液,得
溶液,得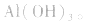 盐水解生成不挥发性酸时,蒸干后一般仍为原物质,如蒸干
盐水解生成不挥发性酸时,蒸干后一般仍为原物质,如蒸干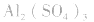 溶液,得
溶液,得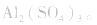
4.盐水解生成强碱时,蒸干后一般得到原物质,如蒸干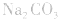 溶液,得到
溶液,得到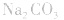 等。
等。
5.有时要多方面考虑,如加热蒸干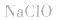 溶液时,既要考虑水解,又要考虑
溶液时,既要考虑水解,又要考虑 的分解,所得固体为
的分解,所得固体为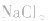
与“下列说法正确的是( )①正常雨水的pH为7.0;酸雨的pH小于7.0②...”考查相似的试题有:
- 下列关于胶体的叙述中,错误的是( )A.胶体是胶状的纯净化合物B.胶体的本质特征是其分散质粒子直径为1-100nmC.利用丁达尔...
- 下列分散系中是胶体的为A 在碘化钾溶液中加入过量的硝酸银溶液,边滴入边振荡B 在碘化钾稀溶液中加入少量的硝酸银溶液,边滴...
- 8g硫与0.2 mol氧气充分反应后的气体总体积在标准状况下为A.1.12 LB.2.24 LC.3.36 LD.4.48 L
- 下列关于硫及含硫化合物的叙述正确的是A.SO2的漂白原理与次氯酸相同B.硫在空气中燃烧生成大量SO3C.浓硫酸可以干燥H2、NH3...
- (16分) 硼位于ⅢA族,三卤化硼是物质结构化学的研究热点,也是重要的化工原料。三氯化硼(BCl3)可用于制取乙硼烷(B2H6),也可作...
- 现有常温下pH均等于5的HCl溶液和NH4Cl溶液,下列说法正确的是[ ]A. 两溶液中n (H+)相等B. 两溶液中c(Cl-)相等C. 两溶液中c...
- 常温时,下列各溶液中,微粒的物质的量浓度关系正确的是A.pH = 5的NaHSO3溶液:[HSO3-]>[H2SO3]>[SO32-]B.pH = 8的苯酚...
- 与CaC2一样,Mg3C2也是离子晶体,与水能发生复分解反应。关于Mg3C2的叙述正确的是A.与水反应有乙炔生成B.与水反应有Mg(OH)2...
- 把AlCl3溶液蒸干后灼烧,最后得到主要固体产物是 ,其原理是 。
- 下列叙述不正确的是A.相同物质的量浓度的①CH3COONa溶液②NaNO3溶液③NH4Cl溶液④NaOH溶液,pH的大小顺序是:④>①>②>③B.在Na2SO3...