本试题 “有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子后3p轨道全满;C原子的p轨道中有3个未成对电子,其气...” 主要考查您对杂化轨道理论(中心原子杂化方式)
晶胞
分子晶体
范德华力
氢键
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 杂化轨道理论(中心原子杂化方式)
- 晶胞
- 分子晶体
- 范德华力
- 氢键
是鲍林为了解释分子的立体结构提出的。中心原子杂化轨道、孤电子对数及与之相连的原子数间的关系是:杂化轨道数=孤电子对数+与之相连的原子数。杂化前后轨道总数比变,杂化轨道用来形成σ键或容纳孤对电子,未杂化的轨道与杂化轨道所在平面垂直,可用来形成π键。
常见杂化方式:
(1)sp杂化:直线型 如:CO2、CS2
(2)sp2杂化:平面三角形(等性杂化为平面正三角形) 如:BCl3 C2H4
不等性杂化为V字型 如:H2O H2S OF2
(3)sp3杂化:空间四面体(等性杂化为正四面体) 如:CH4、CCl4
不等性杂化为三角锥 如:NH3 PCl3 H3O+
sp3d杂化:三角双锥
sp3d2杂化:八面体(等性杂化为正八面体)
分子的构型与杂化类型的关系:
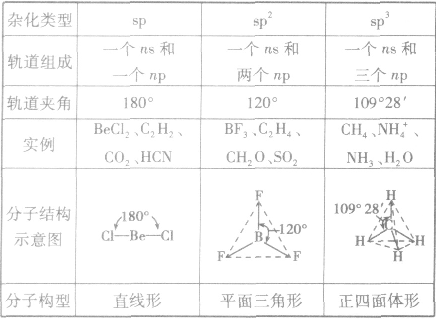
晶胞:
1.定义描述晶体结构的基本单元叫做晶胞。
2.结构一般来说,晶胞为平行六面体,晶胞只是晶体微观空间里的一个基本单元,在它的上、下、左、右、前、后无隙并置地排列着无数晶胞,而且所有晶胞的形状及其内部的原子种类、个数及几何排列是完全相同的。“无隙”是指相邻晶胞之间没有任何间隙,“并置”是指所有晶胞都是平行排列的,取向相同。
晶胞中微粒数目的确定:
计算晶胞中微粒数目的常用方法是均摊法。均摊法是指每个晶胞平均拥有的粒子数目。如某个粒子为n个晶胞所共有,则该粒子有 属于这个晶胞。
属于这个晶胞。
(1)长方体(或正方体)形晶胞中不同位置的粒子数的计算。
①处于顶点的粒子,同时为8个晶胞所共有,每个粒子有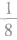 属于该晶胞。
属于该晶胞。
②处于棱上的粒子,同时为4个晶胞所共有,每个粒子有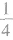 属于该晶胞。
属于该晶胞。
③处于面上的粒子,同时为2个晶胞所共有。每个粒子有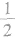 属于该晶胞。
属于该晶胞。
④处于晶胞内部的粒子,则完全属于该晶胞。
(2)非平行六面体形晶胞中粒子数目的计算同样可用均摊法,其关键仍然是确定一个粒子为几个晶胞所共有。例如,石墨晶胞每一层内碳原子排成许多个六边形,其顶点(1个碳原子)对六边形的贡献为 ,那么每一个六边形实际有6×
,那么每一个六边形实际有6× =2个碳原子。
=2个碳原子。
(3)在六棱柱晶胞(如图所示 MgB2的晶胞)中,顶点上的原子为6 个晶胞(同层3个,上层或下层3个) 共有,面上的原子为2个晶胞共有,因此镁原子个数为12×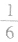 +2×
+2×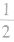 =3,硼原子个数为6。
=3,硼原子个数为6。 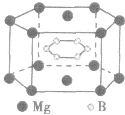
特别提醒:在晶胞中微粒个数的计算过程中,不要形成思维定式,不同形状的晶胞应先分析任意位置上的一个粒子被几个晶胞共用,如六棱柱晶胞中,顶点、侧棱、底面上的棱、面心上的原子依次被6、3、4、2 个晶胞共用。
有关晶胞密度的计算步骤:
①根据“分摊法”算出每个晶胞实际含有各类原子的个数,计算出晶胞的质量m:
②根据边长计算晶胞的体积V:
③根据 进行计算,得出结果。
进行计算,得出结果。
分子之间通过分子间作用力结合形成的晶体,熔沸点低,导热性、延展性不良,导电性差,硬度较小。如:干冰、固态氖。
晶体的基本类型与性质:

晶体结构模型:
| 晶体 | 晶体结构模型 |
| 氯化铯晶体 |  |
| 氯化钠晶体 | 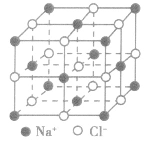 |
| 氟化钙晶体 |  |
| 二氧化碳晶体 | 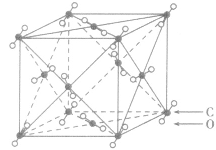 |
| 金刚石晶体 |  |
| SiO2晶体 | 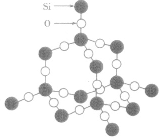 |
| 石墨晶体 (混合晶体) | 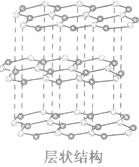 |
晶体中的几个不一定:
(1)由非金属元素构成的晶体不一定为分子品体。如NH4Cl。
(2)具有导电性的晶体不一定是金属晶体。如Si、石墨。
(3)离子晶体不一定只含离子键。如NaOH、 FeS2、Na2O2。
(4)由氢化物构成的晶体不一定是分子晶体。如NaH。
(5)金属与非金属元素构成的晶体不一定是离子晶体。如AlCl3为分子晶体。
(6)原子晶体不一定为绝缘体。如Si。
(7)溶于水能导电的晶体不一定是离子晶体。如HCl。
(8)离子晶体的熔点不一定低于原子晶体。如 MgO的熔点为2852℃,而SiO2的熔点为1710℃。
(9)金属晶体的熔点不一定低于原子晶体。如w 的熔点达34lO℃。
(10)金属晶体的熔点不一定高于分子晶体。如 Hg常温下呈液态,而硫、白磷常温下呈同态.
(11)金属晶体的硬度不一定小于原子晶体。如Cr 的硬度为9,仅次于金刚石。
(12)金属晶体的硬度不一定大于分子晶体。如 Na的硬度只有0.4,可用小刀切割。
(13)晶体巾有阳离子不一定有阴离子。如构成金
范德华力:
(1)概念:分子之间普遍存在的一种把分子聚集在一起的相互作用力。范德华力的作用能通常比化学键的键能小得多,一般只有2~20kJ/mol,主要影响物质的物理性质(熔、沸点和溶解度等)。
(2)规律:组成和结构相似的由分子构成的物质,相对分子质量越大,范德华力越大,物质的熔、沸点越高。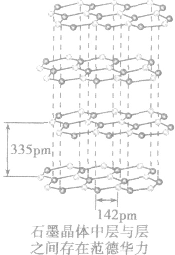
水分子间氢键的表示方法及意义:
(1)表示方法:如下图所示

(2)意义:水分子问存在氢键,使水的熔点和沸点升高,高于同主族其他元素的气态氢化物,所以常温常压下水呈液态。另外,在同态水(冰晶体)中,水分子间以氢键结合成排列规整的晶体,水分子间的氢键使冰的结构里存在较大的空隙,造成体积膨胀、密度减小至低于液态水的密度。水的这种性质对水生动物的生存有重要意义。
范德华力和氢键:
| 范德华力 | 氢键 | |
| 概念 | 把分子聚集在一起的作用力 | 分子中与氢原子形成共价键的非金属元素原子如果吸引电子的能力很强,原子半径很小,则使氢原子几乎成为“裸露”的质子,带部分正电荷,这样的分子之间氢核与带部分负电荷的非金属元素原子相互吸引,这种静电作用就是氢键 |
| 存在范围 | 分子之间 | 某些含强极性键的氢化物分子间(如 HF、H2O、NH3)等 |
| 强弱比较 | 比化学键弱得多 | 比化学键弱,但比范德华力强 |
| 影响因素 | 组成和结构相似的由分子组成的物质,相对分子质量越大,范德华力越大 | 形成氢键的除H外的非金属元素原子吸引电子的能力越强,半径越小,则氢键越强 |
| 对物质性质的影响 | 影响物质的熔沸点、溶解度等物理性质。一般来说,组成和结构相似的由分子组成的物质,随相对分子质量的增大,物质的熔沸点升高,如熔沸点: 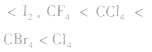 |
分子间氢键的存在,使物质的熔沸点升高,在水中的溶解度增大,如熔沸点:H2O 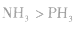 |
氢键:
(1)概念:已经与电负性很大的原子(如N、O、F) 形成共价键的氢原子与另一个电负性很大的原子(如 N、O、F)之问的作用力。如水分子问的氢键如下图所示。 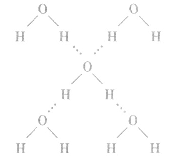
(2)表示方法:A—H…B一(A、B为N、O、F“一” 表示共价键,“…”表示形成的氢键)。
(3)分类
(4)属性:氢键不属于化学键,它属于一一种较强的分子间作用力,其作用能大小介于范德华力和化学键之间。
(5)对物质性质的影响
①氢键对物质熔、沸点的影响。分子问存在氧键时,破坏分子问的氢键,需要消耗更多的能量,所以存在氢键的物质具有较高的熔点和沸点。
例如:氮族、氧族、卤素中的N、O、F的氧化物的熔、沸点的反常现象。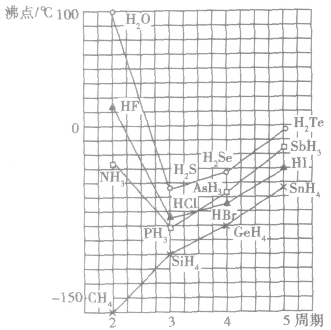
②氢键对物质溶解度的影响:氢键的存在使物质的溶解性增大。例如:NH3极易溶解于水,主要是由于氨分子和水分子之问形成了氢键,彼此互相缔合,因而加大了溶解。再如乙醇、低级醛易溶于水,也是因为它们能与水分子形成氢键。
③氢键的存在会引起密度的变化。水结冰时体积膨胀、密度减小的反常现象也可用氢键解释:在水蒸气中水以单个的水分子形式存在;在液态水中,通常是几个水分子通过氢键结合,形成(H2O)n小集团;在固态水(冰)中,水分子大范围地以氢键互相连接,成为疏松的晶体,因此在冰的结构中有许多空隙,造成体积膨胀,密度减小。
④分子内氢键与分子间氢键对物质性质的不同影响:氢键既可以存在于分子内部的原子之间,也可以存在于分子间的原子之间,只不过这两种情况对物质性质的影响程度是不一样的。例如,邻羟基苯甲醛存在分子内氢键: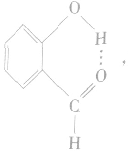 熔点为2℃,沸点为196. 5℃;对羟基苯甲醛存在分子间氢键:
熔点为2℃,沸点为196. 5℃;对羟基苯甲醛存在分子间氢键: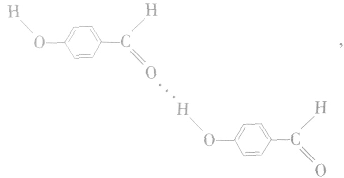 熔点为 115℃,沸点为250℃。由此可见,分子间氢键使物质的熔、沸点更高。
熔点为 115℃,沸点为250℃。由此可见,分子间氢键使物质的熔、沸点更高。
6)存在:水、醇、羧酸、酰胺、氨基酸、蛋白质、结晶水合物等物质中都能存在;生命体中许多大分子内也存在氢键,如氢键是蛋白质具有生物活性的高级结构的重要原因,DNA双螺旋的两个螺旋链也是以氢键相互结合的。
与“有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对...”考查相似的试题有:
- [化学一选修物质结构与性质]A、B、C、D、E都是短周期主族元素,原子序数依次增大,B、C同周期,A、D同主族,E的单质既可溶于...
- (三选一)【物质结构与性质】已知:A、B、C、D为周期表1~36号中的元素,它们的原子序数逐渐增大。A的基态原子有3个不同的能...
- (三选一)【化学--选修 物质结构与性质】用黄铜矿(主要成分是CuFeS2)生产粗铜的反应原理如下(1)已知在反应①、②中均生成...
- (1)石墨属于____晶体,是_____状结构,C原子呈_______杂化;晶体中每个C原子被_______个六边形共用,平均每个环占有_______个...
- 【化学--物质结构与性质】A、B、C都是元素周期表中的短周期元素,它们的核电荷数依次增大.第2周期元素A原子的核外成对电子数...
- 关于氢键,下列说法正确的是( )A.在冰中每一个水分子平均可形成两个氢键B.冰、水和水蒸气中都存在氢键C.氢键属于一种化学...
- 有关晶体的下列说法中正确的是( ) A.分子晶体中分子间作用力越大,分子越稳定B.原子晶体中共价键越强,熔点越高C.蔗糖溶...
- 下列数据是对应物质的熔点(℃)据此做出下列判断中,错误的是[ ]A.铝的化合物晶体中有离子晶体B.表中只有BCl3与干冰是分子晶...
- 实现下列变化时,需克服相同类型作用力的是[ ]A、二氧化硅和干冰的熔化B、液溴和钠的气化C、食盐和冰的熔化D、纯碱和烧碱的熔化
- 下列叙述正确的是( )A.同主族金属的原子半径越大熔点越高B.稀有气体原子序数越大沸点越高C.分子间作用力越弱分子晶体的...