本试题 “现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复)。已知:①A、B两溶液呈碱性;C、D、E溶液呈酸性。②A溶液与E溶液反应既有气...” 主要考查您对离子反应
热化学方程式
粒子浓度大小的比较
物质的鉴别
金属、非金属的有关计算
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 离子反应
- 热化学方程式
- 粒子浓度大小的比较
- 物质的鉴别
- 金属、非金属的有关计算
凡是有离子参加或离子生成的反应都是离子反应。
离子反应包括:复分解反应、氧化还原反应、络合反应、双水解反应
常见阳离子的检验方法:
| 离子 | 检验试剂 | 实验步骤 | 实验现象 | 离子方程式 |
| K+ | 焰色反应 | ①铂丝在火焰上灼烧至原火焰色②蘸取溶液,放在火焰上灼烧,观察火焰颜色。 | 浅紫色(通过蓝色钴玻璃片观察钾离子焰色) | —— |
| Na+ | 焰色反应 | 火焰分别呈黄色 | ||
| NH4+ | NaOH溶液(浓) | 向未知溶液中加入NaOH浓溶液并加热 | 生成有刺激性气味、使湿润红色石蕊试纸变蓝的气体 | NH4++OH-=NH3↑+H2O |
| Al3+ | 加NaOH溶液 | 向未知溶液中加入NaOH溶液 | 加入适量NaOH溶液后生成白色沉淀,该沉淀溶于过量NaOH溶液中 |
Al3++3OH-=Al(OH)3↓ |
| Cu2+ | 浓氨水 | 向未知溶液中加入浓氨水 | 加入适量浓氨水后生成蓝色沉淀,该沉淀溶于过量浓氨水中,溶液呈深蓝色 |
Cu2++2OH-=Cu(OH)2↓ Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O |
| Ag+ | ①稀盐酸或可溶性盐酸盐②稀HNO3③氨水 | 向未知溶液中加入稀盐酸再加入稀HNO3向过滤出的沉淀中加氨水 | 生成白色沉淀,不溶于稀HNO3,但溶于氨水,生成[Ag(NH3)2]+ | Ag++Cl-=AgCl↓ |
| Ba2+ | 稀H2SO4或可溶性酸盐溶液 | 向未知溶液中加入稀H2SO4再加入稀HNO3 | 产生白色沉淀,且沉淀不溶于稀HNO3 | Ba2++SO42-=BaSO4↓ |
| Fe3+ | KSCN溶液 | 向未知溶液中加入KSCN溶液或加NaOH溶液或加苯酚 | 变为血红色溶液 | Fe3++3SCN-=Fe(SCN)3 |
| 加NaOH溶液 | 产生红褐色沉淀 | Fe3++3OH-=Fe(OH)3↓ | ||
| 加苯酚 | 溶液显紫色 | Fe3++6C6H6OH→[Fe(C6H5O)]3-+6H+ | ||
| Fe2+ | ①加NaOH溶液 | 向未知溶液中加入NaOH溶液并露置在空气中 | 开始时生成白色Fe(OH)2沉淀,迅速变成灰绿色,最后变成红褐色Fe(OH)3沉淀。 | Fe2++2OH-=Fe(OH)2↓ 4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
| ②KMnO4 (H+)溶液 | 向未知溶液中加入KMnO4(H+)溶液 | KMnO4(H+)紫色褪去 | MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O | |
| ③K3[Fe(CN)6] | 向未知溶液中加入K3[Fe(CN)6]溶液 | 出现蓝色Fe3[Fe(CN)6]2沉淀 | 3Fe2++2[Fe(CN)6]-=Fe3[Fe(CN)6]2↓ | |
| ④KSCN溶液,新制的氯水 | 加入KSCN溶液,新制的氯水 | 加入KSCN溶液不显红色,加入少量新制的氯水后,立即显红色。 | 2Fe2++Cl2=2Fe3++2Cl-Fe3++3SCN-=Fe(SCN)3 |
常见阴离子的检验方法:
| 离子 | 检验试剂 | 实验步骤 | 实验现象 | 离子方程式 |
| CO32- | ①BaCl2溶液、稀盐酸 | 向未知溶液中加入BaCl2溶液再向沉淀中加入稀盐酸 | 加入BaCl2溶液后生成白色沉淀,沉淀溶于稀盐酸,并放出无色无味气体 | Ba2++CO32-=BaCO3↓ BaCO3+2H+=Ba2++CO2↑+H2O |
| ②稀盐酸、Ca(OH)2溶液 | 加入稀盐酸后放出的气体通入使澄清的Ca(OH)2溶液 | 加入稀盐酸后放出无色无味气体,通入澄清的Ca(OH)2溶液变浑浊 | CO32-+2H+=H2O+CO2↑ Ca2++2OH-+CO2=CaCO3↓+H2O | |
| SO42- | BaCl2溶液、稀硝酸或稀盐酸 | 向未知溶液中加入BaCl2溶液再向沉淀中加入稀盐酸 | 生成不溶于稀硝酸或稀盐酸的白色沉淀 | Ba2++SO42-=BaSO4↓ |
| SO32- | ①BaCl2溶液、稀盐酸 | 向未知溶液中加入BaCl2溶液再向沉淀中加入稀盐酸 | 加入BaCl2溶液后生成白色沉淀,沉淀溶于稀盐酸,并放出刺激性气味的气体 | SO32-+2H+=H2O+SO2↑ |
| ②稀盐酸、品红溶液 | 加入稀盐酸后放出的气体通入品红溶液 | 加入稀盐酸后放出的气体使品红溶液褪色 | SO32-+2H+=H2O+SO2↑ | |
| Cl- | AgNO3溶液、稀硝酸或稀盐酸 | 向未知溶液中加入AgNO3溶液,再向沉淀中加入稀盐酸 | 生成不溶于稀硝酸或稀盐酸的白色沉淀 | Ag++Cl-=AgCl↓ |
| Br- | AgNO3溶液、稀硝酸或稀盐酸 | 生成不溶于稀硝酸或稀盐酸的浅黄色沉淀 | Ag++Br-=AgBr↓ | |
| I- | AgNO3溶液、稀硝酸或稀盐酸 | 向未知溶液中加入AgNO3溶液,再向沉淀中加入稀盐酸 | 生成不溶于稀硝酸的黄色沉淀 | Ag++I-=AgI↓ |
| ②新制氯水,淀粉溶液 | 向未知溶液中加入新制氯水,再加入淀粉溶液 | 滴入新制Cl2,振荡后再滴入淀粉溶液,变蓝 | Ag++I-=AgI↓ 2I-+Cl2=I2+2Cl- I2遇淀粉变蓝 |
2.检验SO32-的试剂中,只能用盐酸,不能用稀硝酸。因为稀硝酸能把SO32-氧化成SO42-。
3.若Ag+和Ba2+同时检验,也需注意检验顺序,应先用盐酸将Ag+检验出并滤去沉淀,然后再用稀硫酸检验Ba2+。
1.定义表示反应所放出或吸收热量的化学方程式,叫做热化学方程式。
2.表示意义不仅表明了化学反应中的物质变化,也表明厂化学反应中的能量变化。例如:
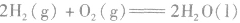 :
: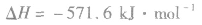 ,表示在25℃、101kPa下,2molH2(g)和1mol O2(g)完全反应生成2molH2O(l)时要释放571.6kJ 的能量。
,表示在25℃、101kPa下,2molH2(g)和1mol O2(g)完全反应生成2molH2O(l)时要释放571.6kJ 的能量。热化学反应方程式的书写:
热化学方程式与普通化学方程式相比,在书写时除厂要遵守书写化学方程式的要求外还应注意以下问题:
1.注意△H的符号和单位 △H只能写在标有反应物和生成物状态的化学方程式的右边。若为放热反应,△H为“-”;若为吸热反应,△H为“+”。△H的单位一般为kJ/moJ。
2.注意反应条件反衄热△H与测定条件(温度、压强等)有关。因此书写热化学方程式时应注明△H的测定条件。绝大多数△H是是25℃、101kPa下测定的,此条件下进行的反应可不注明温度和压强。
3.注意物质的聚集状态反应物和生成物的聚集状态不同,反应热△H不同。因此,必须注明物质的聚集状态才能完整地体现出热化学方程式的意义。气体用“g”,液体用:l“,固体用“s”,溶液用“aq”。
4.注意热化学方程式的化学计量数
(1)热化学方程式中各物质化学式前面的化学计量数仅表示该物质的物质的量,并不表示物质的分子数或原子数,因此化学计量数可以是整数,也可以是分数。
(2)热化学方程式中的反应热表示反应已完成时的热量变化,由于△H与反应完成的量有关,所以方程式中化学式前面的化学计量数必须与△H相对应,如果化学计量数加倍,则△H也要加倍。当反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。
离子浓度大小比较方法:
(1)考虑水解因素:如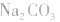 溶液
溶液 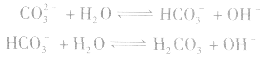
所以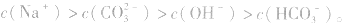
(2)不同溶液中同一离子浓度的比较要看溶液中其他离子对它的影响。如相同浓度的
 三种溶液中,
三种溶液中, 由大到小的顺序是c>a>b。
由大到小的顺序是c>a>b。
(3)混合液中各离子浓度的比较要综合分析水解因素、电离因素。如相同浓度的 的混合液中,离子浓度顺序为:
的混合液中,离子浓度顺序为: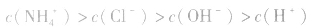
 的电离程度大于
的电离程度大于 的水解程度。
的水解程度。
盐溶液的“三大守恒”:
①电荷守恒:电解质溶液中所有阳离子所带有的正电荷数与所有的阴离子所带的负电荷数相等。如NaHCO3溶液中:
推出: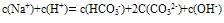
②物料守恒:电解质溶液中由于电离或水解因素,离子会发生变化变成其它离子或分子等,但离子或分子中某种特定元素的原子的总数是不会改变的。如NaHCO3溶液中nc(Na+):nc(C)=1:1,
推出: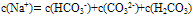
③质子守恒:电解质溶液中分子或离子得到或失去质子(H+)的物质的量应相等。例如在NH4HCO3溶液中H3O+、H2CO3为得到质子后的产物;NH3、OH-、CO32-为失去质子后的产物,故有以下关系: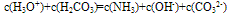
(2)粒子浓度大小比较的方法:
①单一溶液中离子浓度大小的比较
A. 一元弱酸盐溶液中离子浓度的关系是:
c(不水解离子)>c(水解离子)>c(显性离子)>c(水电离出的另一离子)
如:在CH3COONa溶液中各离子浓度大小关系: 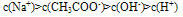
B. 二元弱酸盐溶液中离子浓度的关系是:
c(不水解离子)>c(水解离子)>c(显性离子)> c(二级水解离子)>c(水电离出的另一离子)
如:Na2CO3溶液中离子浓度的关系: 
②比较不同电解质溶液中同一种粒子浓度的大小。应注意弱酸、弱碱电离程度的大小以及影响电离度的因素,盐类水解及水解程度对该粒子浓度的影响。
③比较经过反应化学反应后离子浓度的大小:
A. 确定电解质溶液的成分
B. 确定溶液中含哪些粒子(分子、离子),此时要考虑物质的电离和水解情况
C. 确定各种粒子的浓度或物质的量的大小
D. 根据题目要求做出判断
注:要抓住“两小”。即弱电解质电离程度小,故未电离的弱电解质分子数远多于已电离出离子数目;盐的水解程度小,故未水解的粒子数目远多于水解生成的粒子数目
根据几种不同物质的性质不同及实验现象不同,将其一一区别开。
鉴别是根据化合物的不同性质来确定其含有什么官能团,是哪种化合物。如鉴别一组化合物,就是分别确定各是哪种化合物即可。在做鉴别题时要注意,并不是化合物的所有化学性质都可以用于鉴别,必须具备一定的条件:
(1)化学反应中有颜色变化
(2)化学反应过程中伴随着明显的温度变化(放热或吸热)
(3)反应产物有气体产生
(4)反应产物有沉淀生成或反应过程中沉淀溶解、产物分层等。
互滴现象不同的化学反应:
1.Na2CO3与稀盐酸的反应
(1)向稀盐酸中滴加Na2CO3溶液,立即有气泡产生。
(2)向Na2CO3溶液中滴加稀盐酸,边滴加边振荡,开始不产生气泡,后来产生气泡。
2.Ca(OH)2溶液与H3PO4溶液的反应
(1)向H3PO4溶液中滴加Ca(OH)2溶液,开始不产生白色沉淀,后来产生白色沉淀。
(2)向Ca(OH)2溶液中滴加H3PO4溶液,肝始有白色沉淀,后来白色沉淀逐渐消失。
3.NaOH溶液与AlCl3溶液的反应
(1)向AlCl3溶液中滴加NaOH溶液,开始产生白色沉淀,后来白色沉淀逐渐消失j
(2)向NaOH溶液中滴加AlCl3溶液,开始不产生白色沉淀,后来产生白色沉淀。
4.NaAlO2溶液与稀盐酸反应
(1)向NaAlO2溶液中滴加稀盐酸,开始有白色沉淀产生,后来白色沉淀逐渐消失。
(2)向稀盐酸中滴加NaAlO2溶液,开始不产生白色沉淀,后来产生白色沉淀。
5.AgNO3溶液与NH3·H2O反应
(1)向NH3·H2O中滴加AgNO3溶液,开始不产生沉淀 
(2)向AgNO3溶液中滴加NH3·H2O,开始出现沉淀,最终沉淀消失。
有机化合物的鉴别方法:
(1)烯烃、二烯、炔烃:
①溴的四氯化碳溶液,红色腿去
②高锰酸钾溶液,紫色腿去。
(2)含有炔氢的炔烃:
①硝酸银,生成炔化银白色沉淀
②氯化亚铜的氨溶液,生成炔化亚铜红色沉淀。
(3)小环烃:三、四元脂环烃可使溴的四氯化碳溶液腿色
(4)卤代烃:硝酸银的醇溶液,生成卤化银沉淀;不同结构的卤代烃生成沉淀的速度不同,叔卤代烃和烯丙式卤代烃最快,仲卤代烃次之,伯卤代烃需加热才出现沉淀。
(5)醇:
①与金属钠反应放出氢气(鉴别6个碳原子以下的醇);
②用卢卡斯试剂鉴别伯、仲、叔醇,叔醇立刻变浑浊,仲醇放置后变浑浊,伯醇放置后也无变化。
(6)酚或烯醇类化合物:
①用三氯化铁溶液产生颜色(苯酚产生兰紫色)。
②苯酚与溴水生成三溴苯酚白色沉淀。
(7)羰基化合物:
①鉴别所有的醛酮:2,4-二硝基苯肼,产生黄色或橙红色沉淀;
②区别醛与酮用托伦试剂,醛能生成银镜,而酮不能;
③区别芳香醛与脂肪醛或酮与脂肪醛,用斐林试剂,脂肪醛生成砖红色沉淀,而酮和芳香醛不能;
④鉴别甲基酮和具有结构的醇,用碘的氢氧化钠溶液,生成黄色的碘仿沉淀。
(8)甲酸:用托伦试剂,甲酸能生成银镜,而其他酸不能。
(9)胺:区别伯、仲、叔胺有两种方法
①用苯磺酰氯或对甲苯磺酰氯,在NaOH溶液中反应,伯胺生成的产物溶于NaOH;仲胺生成的产物不溶于NaOH溶液;叔胺不发生反应。
②用NaNO2+HCl:脂肪胺:伯胺放出氮气,仲胺生成黄色油状物,叔胺不反应。芳香胺:伯胺生成重氮盐,仲胺生成黄色油状物,叔胺生成绿色固体。
(10)糖:
①单糖都能与托伦试剂和斐林试剂作用,产生银镜或砖红色沉淀;
②葡萄糖与果糖:用溴水可区别葡萄糖与果糖,葡萄糖能使溴水褪色,而果糖不能。
③麦芽糖与蔗糖:用托伦试剂或斐林试剂,麦芽糖可生成银镜或砖红色沉淀,而蔗糖不能。
(11)使溴水褪色的有机物有:
①不饱和烃(烯、炔、二烯、苯乙烯等);
②不饱和烃的衍生物(烯醇、烯醛等);
③石油产品(裂化气、裂解气、裂化石油等);
④天然橡胶;
⑤苯酚(生成白色沉淀)。
(12)因萃取使溴水褪色的物质有:
①密度大于1的溶剂(四氯化碳、氯仿、溴苯、二硫化碳等);
②密度小于1的溶剂(液态的饱和烃、直馏汽油、苯及其同系物、液态环烷烃、液态饱和酯)。
(13)使酸性高锰酸钾溶液褪色的有机物有:
①不饱和烃;②苯的同系物;③不饱和烃的衍生物;④部分醇类有机物;⑤含醛基的有机物:醛、甲酸、甲酸酯、甲酸盐;⑥石油产品(裂解气、裂化气、裂化石油);⑦天然橡胶。
包括金属及化合物、金属与非金属化合物、非金属化合物之间的反应的计算,解此类题的关键是正确的写出反应方程式,明确物质间的等量关系。明确物质之间的反应,正确写出方程式,此类题可迎刃而解。
AlCl3与NaOH反应的相关计算:
1、求Al(OH)3沉淀的量
2、求反应物碱的量
铝与酸、碱反应的计算规律:
铝分别与盐酸、氢氧化钠溶液反应的原理: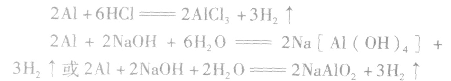
(1)等量铝分别与足量盐酸和氢氧化钠溶液反应,产生氢气的体积比为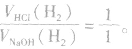
(2)足量的锅分别与等物质的量的盐酸和氢氧化钠溶液反应,产生氢气的体积比为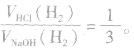
(3)一定量的铝分别和一定量的盐酸和氢氧化钠溶液反应,若产生氢气的体积比为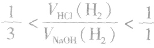 ,则必定是:
,则必定是:
①铝与盐酸反应时,铝过量而盐酸不足;
②铝与氢氧化钠溶液反应时,铝不足而氢氧化钠过量。
解有关硝酸与金属反应的计算题的技巧:
1.灵活运用得失电子守恒、原子守恒及溶液中的电荷守恒关系例如Cu与HNO3反应中就有以下等量关系:
(1)N原子守恒:反应前所有的N只存在于HNO3中;反应后含N的物质有HNO3的还原产物(假设此处有NO3、NO)和Cu(NO3)3,若HNO3过量,则过量HNO3中也含一部分N,则有:n(N)=n(NO2)+ n(NO)+2n[Cu(NO3)3]+n剩(HNO3)。
(2)得失电子守恒:在反应中失去电子的是参加反应的Cu, ;得到电子的是被还原的HNO3(假设还原产物为NO2、NO),NO3-+e→ NO2、NO3-+3e→NO。根据得失电子守恒,则有:
;得到电子的是被还原的HNO3(假设还原产物为NO2、NO),NO3-+e→ NO2、NO3-+3e→NO。根据得失电子守恒,则有: 
(3)溶液中的电荷守恒:在任何溶液中,阴离子所带负电荷总数与阳离子所带正电荷总数在数值上是相等的。在Cu与HNO3反应后的溶液中,若HNO3不过量,阳离子只有Cu2+,阴离子只有NO3-(此类计算不考虑H2O电离出的极少量的H+、OH-);若HNO3过量,溶液中阳离子有Cu2+和H+,阴离子只有NO3-。则有:
①若HNO3不过量: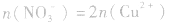
②若HNO3过量: 
2.铁与稀HNO3的反应规律 

(2)上述反应可以认为先发生反应①,若Fe有剩余则发生 ①×2+ ③即得反应②,所以,无论是反应①还是反应②,被还原的HNO3皆占参加反应的HNO3的
①×2+ ③即得反应②,所以,无论是反应①还是反应②,被还原的HNO3皆占参加反应的HNO3的 。
。
有关镁、铝的图像集锦:
Al(OH)3与Al3+、AlO2-之间的转化,是建立在 Al(OH)3两性基础上的,有关相互转化的配比和沉淀Al(OH)3的质量变化,见下表:
与“现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离...”考查相似的试题有:
- 有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份均为100mL溶...
- 已知NH4++AlO2-+2H2O=Al(OH)3↓+NH3•H2O,向含有等物质的量的NH4+、Al3+、H+混合溶液中,慢慢滴加NaOH溶液,直至过量,发生...
- 下列离子的检验方法合理的是( )A.向某溶液中滴入KSCN溶液呈红色,说明不含Fe2+B.向某溶液中通入Cl2,然后再加入KSCN溶液...
- 按要求写热化学方程式:(1)已知稀溶液中,1 mol H2SO4与NaOH溶液恰好完全反应时,放出114.6 kJ热量,写出表示H2SO4与NaOH反应...
- 下列说法正确的是( )A.向0.1mol/L的氨水中加入少量硫酸铵固体,则溶液中C(OH-)C(NH3•H2O)减少B.25℃时,pH=2的一元酸溶液...
- 已知硫酸在水中的电离方程式是:H2SO4═ H++ HSO4-, HSO4-H++SO42-,回答下列问题:(1)Na2SO4溶液显_______(填“酸性”,“中...
- 用氢气、碳、一氧化碳分别与等质量的氧化铜在高温下反应,使氧化铜中的铜全部还原出来,至少消耗氢气、碳、一氧化碳的质量之...
- 将0.4gNaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质...
- 工业上用于合成氨的原料气--氢气,来源之一是取自石油气,如用丙烷在一定条件下与水反应:C3H8+6H2O→3CO2+ 10H2,按此原理1 m...
- 使一定质量的锌与100mL 18.5mol ·L-1浓硫酸充分反应。(1 )若锌完全溶解,同时只生成SO2气体3.36L( 标准状况下) ,求所得溶...