本试题 “下列说法不正确的是[ ]A.纸层析通常把不与水混溶的有机溶剂作为流动相B.制摩尔盐时用酒精洗涤产品,而在制阿司匹林时用水洗涤产品C.减压过滤是为了加快过...” 主要考查您对活化分子、活化能、有效碰撞
过滤
层析
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 活化分子、活化能、有效碰撞
- 过滤
- 层析
有效碰撞与活化分子:
1.化学反应过程就是反应物分子分裂成原子,原子重新组合成生成物分子的过程,也就是反应物分子中化学键断裂、生成物分子中化学键形成的过程。
2.旧键的断裂和新键的形成都是通过反应物分子 (或离子)的相互碰撞来实现的。反应物分子(或离子)问的碰撞是化学反应发生的先决条件,但并不是反应物分子的每次碰撞都能发生化学反应。
3.能够发生化学反应的分子碰撞叫做有效碰撞,把能够发生有效碰撞的分子叫做活化分子。活化分子具有比普通分子(非活化分子)更高的能量。活化分子在碰撞后有可能使原子问的化学键断裂,从而导致化学反应的发生。但并不是活化分子的每次碰撞都能引起化学反应。
4.分子间的自由碰撞必然会有不同的碰撞取向。研究发现,有效的分子碰撞,分子除了要有足够的能量以外,还要有合适的碰撞取向。从分子能量的方面来看,活化分子具备发生有效碰撞的条件。从分子碰撞取向的方向来看,活化分子的某次碰撞并不一定能引发化学反应。若活化分子碰撞取向合适,才能发生化学反应;若活化分子碰撞取向不合适,则化学反应不能发生。也就是说,只有活化分子以合适的取向发生碰撞,才能使分子内的化学键断裂,从而引发化学反应。或者说,具有较高能量的活化分子按照合适的取向所发生的有效碰撞才能引发化学反应。
5.为了把“有效碰撞”概念具体化,人们把能够发生有效碰撞的分子叫做活化分子,同时把活化分子所多出来的那部分能量叫做活化能,因此活化能是活化分子平均能量与普通反应物分子平均能量的差值。
6.活化能相当于化学反应的“门槛”,对于同一化学反应,其活化能越低,反应速率越快。催化剂就是通过参与反应,改变反应历程,降低反应的活化能来提高反应速率的。
1.化学反应过程就是反应物分子分裂成原子,原子重新组合成生成物分子的过程,也就是反应物分子中化学键断裂、生成物分子中化学键形成的过程。
2.旧键的断裂和新键的形成都是通过反应物分子 (或离子)的相互碰撞来实现的。反应物分子(或离子)问的碰撞是化学反应发生的先决条件,但并不是反应物分子的每次碰撞都能发生化学反应。
3.能够发生化学反应的分子碰撞叫做有效碰撞,把能够发生有效碰撞的分子叫做活化分子。活化分子具有比普通分子(非活化分子)更高的能量。活化分子在碰撞后有可能使原子问的化学键断裂,从而导致化学反应的发生。但并不是活化分子的每次碰撞都能引起化学反应。
4.分子间的自由碰撞必然会有不同的碰撞取向。研究发现,有效的分子碰撞,分子除了要有足够的能量以外,还要有合适的碰撞取向。从分子能量的方面来看,活化分子具备发生有效碰撞的条件。从分子碰撞取向的方向来看,活化分子的某次碰撞并不一定能引发化学反应。若活化分子碰撞取向合适,才能发生化学反应;若活化分子碰撞取向不合适,则化学反应不能发生。也就是说,只有活化分子以合适的取向发生碰撞,才能使分子内的化学键断裂,从而引发化学反应。或者说,具有较高能量的活化分子按照合适的取向所发生的有效碰撞才能引发化学反应。
5.为了把“有效碰撞”概念具体化,人们把能够发生有效碰撞的分子叫做活化分子,同时把活化分子所多出来的那部分能量叫做活化能,因此活化能是活化分子平均能量与普通反应物分子平均能量的差值。
6.活化能相当于化学反应的“门槛”,对于同一化学反应,其活化能越低,反应速率越快。催化剂就是通过参与反应,改变反应历程,降低反应的活化能来提高反应速率的。
过滤:
| 名称 | 用途 | 装置 | 举例 | 注意事项 |
| 过滤 | 分离固体和液体混合物 | 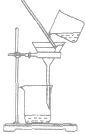 |
粗盐提纯时把粗盐溶于水,经过滤把不溶于水的杂质除去 | ①要“一贴二低三靠” 滤纸紧贴漏斗内壁;滤纸边缘低于漏斗口,漏斗里液面低于滤纸边缘;烧杯口紧靠玻璃棒,玻璃捧下端紧靠三层滤纸.漏斗下端紧靠烧杯内壁。 ②必要时洗涤沉淀物(在过滤器中加少量水),不可搅拌 |
层析:
利用各组分物理性质的不同,将多组分混合物进行分离及测定的方法。
利用各组分物理性质的不同,将多组分混合物进行分离及测定的方法。
发现相似题
与“下列说法不正确的是[ ]A.纸层析通常把不与水混溶的有机溶剂...”考查相似的试题有:
- 如图所示,下列能量中表示活化能的是[ ]A.E1B.E2C.E3D.E4
- 某氯化铁样品含有少量FeCl2杂质.现要测定其中铁元素的质量分数,实验按以下步骤进行:请根据上面流程,回答以下问题:(1)...
- 下列减压过滤装置示意图正确的是( ) A. B. C. D.
- 下列实验操作不正确的是( )A.分液时,上层液体上口出,下层液体下口出B.蒸馏烧瓶内液体的体积不超过其容积的23就可以C....
- 已知硝酸银与氯化钾反应生成硝酸钾和不溶于水的氯化银,化学方程式为AgNO3+KCl═AgCl↓+KNO3.将含有少量氯化钾的硝酸钾固体提...
- 下列有关实验基本操作的说法错误的是( )A.存放浓硝酸时,使用带玻璃塞的棕色玻璃瓶B.酸碱中和滴定时,若未用待测液润洗锥...
- 下列叙述中不正确的是[ ]A.过滤时,漏斗下端要紧贴接液烧杯内壁B.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口C.分液时,...
- 在走访调查中,小红观察到某乡镇颜料厂排出的废水带有颜色,经鉴定含有铅.为了测定废水中铅的浓度,他设计了如下实验步骤:...
- 下列实验操作中,错误的是( )A.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出B.过滤可以除掉粗盐中可溶于水的...
- 实验室里进行过滤和蒸发操作都要用到的仪器是( )A.烧杯B.玻璃棒C.蒸发皿D.酒精灯