本试题 “化学在生产和日常生活中有着重要的应用。下列叙述正确的是[ ]A. 氧化铝的熔点很低,不能用于制作耐高温材料B. 在海轮外壳上镶入锌块,会加快船体的腐蚀速率C....” 主要考查您对氧化铝
硅酸盐
氯气
金属的电化学腐蚀
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 氧化铝
- 硅酸盐
- 氯气
- 金属的电化学腐蚀
氧化铝的性质:
- 物理性质:白色固体,熔点高,是较好的耐火材料,天然的Al2O3叫刚玉,硬度仅次于金刚石;
- 化学性质:不溶于水的两性化合物,既能与酸反应,又能与强碱反应。
(1)与酸反应: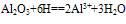
(2)与碱反应:
氧化铝的两性:
氧化铝属于两性氧化物,既能与酸反应,也能与强碱反应:
Al2O3+6H+===2Al3++3H2O
Al2O3+2OH-===2AlO2-+H2O
氧化铝与氧化镁的比较:
| 氧化物 | MgO | Al2O3 | |
| 工业制备 | MgCO3=(煅烧)=MgO+CO2↑ | 铝土矿——Al2O3 | |
| 中央物理性质 | 白色固体,熔点高,密度小 | 白色固体,熔点高,密度较小 | |
| 主要化学性质 | H2O | MgO+H2O==Mg(OH)2,很慢 | 不溶解,也不反应 |
| H+ | MgO+2H+==Mg2++H2O | Al2O3+6H+==2Al3++3H2O | |
| OH- | 不反应 | Al2O3+2OH-==2AlO2-+H2O | |
| 重要用途 | 制造耐火、耐高温器材 | 制造耐火、耐高温器材;工业冶炼铝 | |
①硅酸盐是构成地壳岩石的主要成分,其结构复杂,组成可用二氧化硅和金属氧化物的形式表示。例如:硅酸钠Na2SiO3(Na2O·SiO2);镁橄榄石Mg2SiO4(2MgO·SiO2);高岭石Al2(Si2O5)(OH)4(Al2O3·2SiO2·2H2O)
②云母、滑石、石棉、高岭石等,它们都属于天然的硅酸盐。
③人造硅酸盐:主要有玻璃、水泥、各种陶瓷、砖瓦、耐火砖、水玻璃以及某些分子筛等。
④硅酸盐制品性质稳定,熔点较高,难溶于水,有很广泛的用途。最简单硅酸盐是硅酸钠,其水溶液俗称水玻璃,是一种矿物胶,可作粘合剂,防腐剂。
硅酸钠:
(1)化学式:Na2SiO3
(2)俗称:其水溶液俗称水玻璃
(3)物理性质:硅酸钠溶液是无色黏稠液体
(4)化学性质:
①与盐酸反应 Na2SiO3+2HCl==== 2NaCl+H2SiO3(胶体)
②与CO2反应 NaSiO3+CO2+H2O ==Na2CO3+H2SiO3↓
③与水发生水解反应硅酸钠溶液显碱性
(5)制备:SiO2+2NaOH== Na2SiO3+H2O
(6)保存:试剂瓶不能配磨口玻璃塞
(7)用途:常用于制备硅胶和木材防火剂等
氯气:
①化学式:Cl2
②氯元素在周期表中的位置:第三周期ⅦA族
③氯原子的电子式: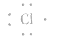
④氯的原子结构示意图: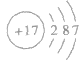
⑤氯原子的外围电子排布式:
⑥化学键类型:非极性共价键
⑦氯分子的电子式:
⑧氯分子的结构式:
氯气的物理性质和化学性质:
(1)物理性质:黄绿色,有刺激性气味,有毒,密度比空气大,能溶于水(1:2)。
(2)化学性质:氯气(Cl2)是双原子分子,原子的最外层有七个电子,是典型的非金属元素,单质是强氧化剂。
①氯气与金属反应: 2Na+Cl2
 2NaCl(反应剧烈,产生大量白烟) 2Fe+3Cl2
2NaCl(反应剧烈,产生大量白烟) 2Fe+3Cl2 2FeCl3(反应剧烈,产生大量棕褐色烟,溶于水成黄色溶液) Cu+Cl2
2FeCl3(反应剧烈,产生大量棕褐色烟,溶于水成黄色溶液) Cu+Cl2 CuCl2(反应剧烈,产生大量棕色的烟,溶于水成蓝色或绿色溶液)氯气能与绝大数金属都能发生反应,表明氯气是一种活泼的非金属单质。
CuCl2(反应剧烈,产生大量棕色的烟,溶于水成蓝色或绿色溶液)氯气能与绝大数金属都能发生反应,表明氯气是一种活泼的非金属单质。 ②与非金属的反应 H2+Cl2
 2HCl(纯净的氢气在氯气中安静的燃烧,芒白色火焰,在瓶口处有白雾产生)H2+Cl2
2HCl(纯净的氢气在氯气中安静的燃烧,芒白色火焰,在瓶口处有白雾产生)H2+Cl2 2HCl(发生爆炸) 2P+3Cl2
2HCl(发生爆炸) 2P+3Cl2 2PCl3(液态) PCl3+Cl2==PCl5(固态)磷在氯气中剧烈燃烧,产生大量的烟、雾。雾是PCl3,烟是PCl5。氯气能有很多非金属单质反应,如S、C、Si等。
2PCl3(液态) PCl3+Cl2==PCl5(固态)磷在氯气中剧烈燃烧,产生大量的烟、雾。雾是PCl3,烟是PCl5。氯气能有很多非金属单质反应,如S、C、Si等。 ③与碱反应 Cl2+2NaOH==NaCl+NaClO+H2O 2Cl2+2Ca(OH)2==CaCl2+Ca(ClO)2+2H2O
④与某些还原性物质反应:Cl2+2FeCl2===2FeCl3 Cl2+SO2+2H2O==2HCl+H2SO4
⑤有机反应(参与有机反应的取代和加成反应)
CH4+Cl2→CH3Cl+HCl
CH3Cl+Cl2→CH2Cl2+HCl
CH2Cl2+Cl2→CHCl3+HCl
CHCl3+Cl2→CCl4+HCl
Cl2+CH2=CH2→CH2Cl-CH2Cl(加成反应)
⑥与水反应 Cl2+H2O
 HCl+HClO
HCl+HClO 金属的腐蚀:
1.金属腐蚀的概念金属与周围的气体或液体物质发生氧化还原反应而引起损耗的现象。
2.金属腐蚀的实质金属原子(M)失去电子而被氧化的过程。
M-ne-==M n+
金属的电化学腐蚀:
不纯的金属或合金因发生原电池反应而造成的腐蚀。最普遍的钢铁腐蚀是:
负极:2Fe-4e-=2Fe2+
正极:O2+2H2O+4e-=4OH- (注:在少数情况下,若周围介质的酸性较强,正极的反应是:2H++2e-=H2↑)
金属的腐蚀以电化腐蚀为主.例如,钢铁生锈的主要过程为
(1)吸氧腐蚀:金属在酸性很弱或中性溶液里,空气里的氧气溶解于金属表面水膜中而发生的电化腐蚀。
①发生条件:水膜的酸性很弱或呈中性
②反应本质:形成原电池
③铁为负极,(氧化反应);正极反应:(还原反应)
(2)析氢腐蚀:在酸性较强的溶液中发生电化腐蚀时放出氢气,这种腐蚀叫做析氢腐蚀。
①发生条件:水膜的酸性较强
②反应本质:形成原电池
③铁为负极,(氧化反应);正极反应:(还原反应)
钢铁的电化学腐蚀的两种类型:


金属腐蚀快慢的判断:
金属腐蚀的快慢与下列两个因素有关:
(1)与构成原电池的材料有关,两极材料的活泼性差别越大,电动势越大,氧化还原反应的速率越快,活泼金属被腐蚀的速率就越快。
(2)与金属所接触的电解质溶液的性质有关,活泼金属在电解质溶液中的腐蚀快于在非电解质溶液中的腐蚀,在强电解质溶液中的腐蚀快于在弱电解质溶液中的腐蚀。一般来说,可用下列原则判断:电解原理引起的腐蚀>原电池原理引起的腐蚀> 化学腐蚀>有防护措施的腐蚀
与“化学在生产和日常生活中有着重要的应用。下列叙述正确的是[ ]...”考查相似的试题有:
- 某课外活动小组实验测得某硅酸盐所含氧化物的质量分数如下表:氧化物CaOAl2O3SiO2H2O质量分数0.142 00.260 20.459 20.137 8请...
- 下列物质主要成分为硅酸盐的是( )①钢化玻璃 ②水玻璃 ③玻璃纸 ④石英玻璃 ⑤有机玻璃A.①②B.①④C.③④D.②④
- (13分)如图所示,是一个制取氯气并以氯气为原料进行特定反应的装置,其中各试剂瓶装的试剂为:B(品红溶液;一种常见的红色...
- 将H2点燃后插入氯气的集气瓶中,产生的现象是A.爆炸B.瓶内充满棕色烟C.火焰立刻熄灭D.安静燃烧,产生苍白色火焰
- 化学与生活密切相关,下列情况会对人体健康造成较大危害的是[ ]A.用Cl2对自来水进行消毒杀菌B.用SO2漂白食品C.用食醋清洗...
- 生活中难免会遇到一些突发事件,我们要善于利用学过的知识,采取科学、有效的方法保护自己.如果发生了氯气(能与碱性溶液反...
- 炒过菜的铁锅未及时洗净,在空气中不久便会因腐蚀而出现红褐色锈斑。请回答:(1)铁锅的锈蚀是_______腐蚀(填“析氧"或“吸氧” ...
- 下列有关金属腐蚀与防护的说法正确的是( )A.在铁门上焊接后铜块既美观,又能防腐蚀B.古代青铜文物在干燥环境中的腐蚀比潮...
- 家用炒菜铁锅用水清洗放置后,出现红棕色的锈斑,在此变化过程中不发生的化学反应是[ ]A.4Fe(OH)2+2H2O+O2==4Fe(OH)3B.2Fe+...
- 下列实验设计合理的是( )A.除去粗盐中的Ca2+、Mg2+、SO42-,依次加入H2O和Na2CO3、Ba(OH)2、HCl溶液B.如图所示装置能用...