本试题 “化学中常用图象直观地描述化学反应的进程或结果。下列图象描述正确的是[ ]A.B.C.D.” 主要考查您对碳单质及化合物
达到化学平衡的标志
弱电解质电离的影响因素
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 碳单质及化合物
- 达到化学平衡的标志
- 弱电解质电离的影响因素
碳:
①元素符号:C
②原子结构示意图: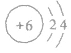
③电子式: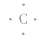
④周期表中位置:第二周期ⅣA族
⑤含量与存在:在地壳中的含量为0.087%,在自然界中既有游离态,又有化合态
⑥同素异形体:金刚石、石墨、C60、活性炭
碳(活性炭):
①金刚石:纯净的金刚石是无色透明、正八面体形状的固体,硬度大,熔点高,不导电,不溶于水
石墨:深灰色的鳞片状固体,硬度小,质软,有滑腻感,熔点高,具有导电性
活性炭:黑色粉末状或颗粒状的无定形碳,疏松多孔,有吸附性
②碳的化学性质:
a.稳定性:在常温下碳的化学性质稳定,点燃或高温的条件下能发生化学反应
b.可燃性:氧气充足的条件下:C+O2 CO2 氧气不充分的条件下:2C+O2
CO2 氧气不充分的条件下:2C+O2 2CO
2CO
c.还原性:
木炭还原氧化铜:C+2CuO 2Cu+CO2↑
2Cu+CO2↑
焦炭还原氧化铁:3C+2Fe2O3 4Fe+3CO2↑
4Fe+3CO2↑
焦炭还原四氧化三铁:2C+Fe3O4 3Fe+2CO2↑
3Fe+2CO2↑
木炭与二氧化碳的反应:C+CO2 CO
CO
二氧化碳:
①物理性质:常温下,二氧化碳是一种无色无味的气体,密度比空气大,能溶于水。固态的二氧化碳叫做干冰。
②化学性质:
a.一般情况下,二氧化碳不能燃烧,也不支持燃烧,不供给呼吸,因此当我们进入干枯的深井,深洞或久未开启的菜窖时,应先做一个灯火实验,以防止二氧化碳浓度过高而造成危险
b.二氧化碳和水反应生成碳酸,使紫色石蕊试液变红:CO2+H2O===H2CO3,碳酸不稳定,很容易分解成水和二氧化碳,所以红色石蕊试液又变回紫色:H2CO3===H2O+CO2↑
c.二氧化碳和石灰水反应:Ca(OH)2+CO2====CaCO3↓+H2O
d.二氧化碳可促进植物的光合作用:6CO2+6H2O C6H12O6+6O2
C6H12O6+6O2
③用途:
a.二氧化碳不支持燃烧,不能燃烧,比空气重,可用于灭火
b.干冰升华时吸收大量的热,可用它做制冷剂或人工降雨
c.工业制纯碱和尿素,是一种重要的化工原料 d.植物光合作用,绿色植物吸收太阳能,利用二氧化碳和水,合成有机物放出氧气。
一氧化碳:
①物理性质:通常状况下,是一种没有颜色,气味的气体,比空气略轻难溶于水。
②化学性质
a.可燃性:2CO+O2 2CO2
2CO2
b.还原性:一氧化碳还原氧化铜:CO+CuO Cu+CO2 一氧化碳还原氧化铁:3CO+Fe2O3
Cu+CO2 一氧化碳还原氧化铁:3CO+Fe2O3 2Fe+3CO2 一氧化碳还原四氧化三铁:4CO+Fe3O4
2Fe+3CO2 一氧化碳还原四氧化三铁:4CO+Fe3O4 3Fe+4CO2
3Fe+4CO2
c.毒性:一氧化碳能与人体血液中的血红蛋白结合,使血红蛋白失去运输氧气的能力,造成机体缺氧。冬天用煤火取暖,如排气不良,就会发生煤气中毒,就CO中毒。CO重要来源是汽车尾气和煤,石油等含碳燃料的不完全燃烧。
③用途:用作燃料,冶炼金属。 ④碳酸:弱酸,不稳定,易分解H2CO3==CO2↑+H2O
碳酸盐:
1.正盐与酸式盐的比较
| 正盐 | 酸式盐 | |
| 水溶性 | 除K、Na、铵的碳酸盐易溶于水外,其余都难溶于水 | 都溶于水 |
| 热稳定性 | 较稳定 ①K2CO3、Na2CO3等碱金属的正盐受热难分解 ②CaCO3、(NH4)2CO3 等受热易分解 |
受热易分解 2NaHCO3  Na2CO3+ H2O+CO2↑ Na2CO3+ H2O+CO2↑Ca(HCO3)2  CaCO3+H2O+CO2↑ CaCO3+H2O+CO2↑ |
| 与酸反应 | CO32-+2H+== CO2↑+H2O CaCO3+2H+=Ca2+ +H2O+CO2↑ |
HCO3-+H+==H2O+ CO2↑(相同条件下,NaHCO3与酸反应放出CO2的速率比Na2CO3快) |
| 与碱反应 | Na2CO3+Ca(OH)2 ==CaCO3↓+2NaOH | NaHCO3+NaOH==Na2CO3+H2O Ca(HCO3)2+Ca(OH)2==2CaCO3↓+2H2O |
| 转化关系 |  | |
(1)在水中的溶解性:一般地,相同温度下,难溶性正盐的溶解度小于其酸式盐,可(易)溶性正盐的溶解度大于其酸式盐。如CaCO3,难溶于水,Ca(HCO3)2易溶于水;Na2CO3易溶于水,NaHCO3的溶解度比 Na2CO3的小。
(2)与酸或碱反应:强酸的酸式盐只与碱反应而不与酸反应;弱酸的酸式盐与足量强碱反应生成正盐,与足量强酸反应生成弱酸。
(3)热稳定性:一般地,热稳定性的大小顺序为正盐>酸式盐(盐的阳离子相同,成盐的酸相同)。
3.碳酸钙在自然界中存在广泛,是岩石的主要成分之一。不溶于水,但溶于酸。大理石、石灰石的主要成分是CaCO3,它们既是重要的化工原料,又是重要的建筑材料。其用途图示如下:
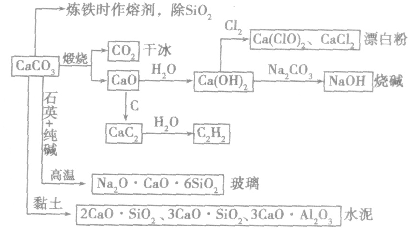
CO2气体与溶液的反应规律:
1.向某溶液中不断通入CO2气体至过量时,现象是“先产生白色沉淀,后沉淀逐渐溶解”
(1)向澄清石灰水中不断通入CO2气体的反应为:
Ca(OH)2+CO2==CaCO3↓+H2O
CaCO3+CO3+H3O==Ca(HCO3)2
(2)向氧氧化钡溶液中不断通入CO2气体的反应为:
Ba(OH)2+CO2==BaCO3↓+H2O
BaCO3+CO2+H2O==Ba(HCO3)2
(3)向漂白粉溶液中不断通入CO2气体的反应为:
Ca(ClO)2+CO2+H2O==CaCO3↓+2HClO
CaCO3+CO2+H2O==Ca(HCO3)2
2.向某溶液中不断通入CO2气体至过量时,现象为“产生白色沉淀或浑浊,沉淀或浑浊不消失”
(1)在NaAlO2溶液中不断通入CO2气体至过量时,反应为:
2AlO2-+CO2(少量)+3H2O==2Al(OH)3↓ +CO32-
2AlO2-+CO2(过量)+2H2O==Al(OH)3↓ +HCO3-
(2)向Na2SiO3溶液中不断通入CO2气体至过量时,反应为:
SiO32-+CO2+H2O==H2SiO3↓+CO32-
SiO32-+2CO2+2H2O==H2SiO3↓+2HCO3-
(3)向饱和Na2CO3溶液中不断通入CO2气体,反应为:
2Na++CO32-+CO2+H2O==2NaHCO3↓
3.CO2与NaOH溶液反应后,溶液中溶质的判断将CO2气体逐渐通入NaOH溶液中,先后发生化学反应:
①CO2+2NaOH==Na2CO3+H2O
②CO2+Na2CO3+H2O==2NaHCO3
向一定量的NaOH溶液中通入CO2气体后,溶液中溶质的成分要根据NaOH与CO2的物质的量之比进行讨论。
当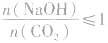 时,发生反应①和②,溶液中的溶质为NaHCO3;
时,发生反应①和②,溶液中的溶质为NaHCO3;
当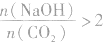 时,发生反应①,溶液中的溶质为 Na2CO3和NaOH;
时,发生反应①,溶液中的溶质为 Na2CO3和NaOH;
当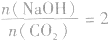 时,发生反应①,溶液中的溶质为Na2CO3;
时,发生反应①,溶液中的溶质为Na2CO3;
当 时,发生反应①和②,溶液中为Na2CO3和NaHCO3
时,发生反应①和②,溶液中为Na2CO3和NaHCO3
碳酸氢盐与碱反应的规律及CO32- HCO3-的鉴别方法:
1.酸式盐与碱反应时的产物要根据相对用量判断
如Ca(HCO3)2溶液中滴加NaOH溶液:
Ca(HCO3)2+NaOH==CaCO3↓+NaHCO3+ H2O(NaOH少量)
Ca(HCO2)2+2NaOH==CaCO3↓+Na2CO3+ 2H2O(NaOH过量)
2.CO32-和HCO3-的鉴别
(1)利用正盐和酸式盐的溶解性可区别CO32-和HCO3-,如分别和BaCl2溶液反应,生成的BaCO3不溶,生成的Ba(HCO3)2易溶;
(2)利用与H+反应产生CO2的快慢检验CO32-或HCO3-
碳族元素:
1.在元素周期表中的位置及结构碳旌死素位于第ⅣA族,包括碳(C)、硅(Si)、锗(Ge)、锡(Sn)、铅(Pb)五种元素。最外层皆有4个电子,这种结构不易得电子也不易失电子,易形成共价键,难形成离子键。
2.主要化合价碳族元素的化合价主要有+2和+4,C、Si、Ge、Sn的+4价化合物较稳定,而Pb的+2价化合物较稳定。
3.氢化物、最高价氧化物及其对应的水化物
氢化物:
最高价氧化物:RO2;
最高价氧化物对应的水化物为H2RO3、 H4RO4或R(OH)4
4.碳族元素的金属性与非金属性的递变规律由C至Pb,核电荷数逐渐增多,原子半径逐渐增大,原子核对最外层电子的吸引能力逐渐减小,失电子能力逐渐增强,得电子能力逐渐减弱,非金属性逐渐减弱,金属性逐渐增强。由碳族元素形成的单质中,碳、硅为非金属,但硅有金属光泽;锗、锡、铅为金属。
1.当一个可逆反应达到平衡状态后,如果改变温度、压强、浓度等反应条件.原来的平衡状态会被破坏,化学平衡会发生移动,平衡混合物中各组成物质的质量分数也就随着改变,在一段时间后达到新的平衡状态,这种由原平衡状态向新平衡状态的变化过程。就是化学平衡的移动。以上过程可归纳如下:

2.化学平衡移动与化学反应速率的关系
当与化学平衡体系有天的外界条件改变以后,
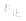 >
>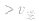 ,化学平衡向正反应方向移动;
,化学平衡向正反应方向移动; ,化学平衡不移动;
,化学平衡不移动;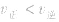 ,化学平衡向逆反应方向移动。
,化学平衡向逆反应方向移动。化学平衡状态:
(1)定义:在一定条件下的可逆反应中,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态,叫做化学平衡状态,简称化学平衡。
(2)化学平衡的建立对于可逆反应,不管从正反应开始(只投入反应物),还是从逆反应开始(只投入生成物),或从正、逆反应同时开始(同时投入反应物和生成物),在一定条件下都会达到
 的状态。当
的状态。当 相等时,单位时间内同一物质消耗与生成的量完全相等,因而各物质的浓度和百分含量保持一定,即达到化学平衡状态。构成化学平衡体系的基本要求是反应物和所有的生成物均处于同一反应体系中,反应条件(温度、浓度、压强等)保持不变。
相等时,单位时间内同一物质消耗与生成的量完全相等,因而各物质的浓度和百分含量保持一定,即达到化学平衡状态。构成化学平衡体系的基本要求是反应物和所有的生成物均处于同一反应体系中,反应条件(温度、浓度、压强等)保持不变。 化学平衡的特征:
(1)逆:只有可逆反应才能达到化学平衡状态。
(2)动:是动态平衡,正、逆反应仍在不断进行。
(3)等:
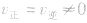 。
。(4)定:各组分的浓度及百分含量保持一定。
(5)变:当影响化学平衡的外界条件发生变化使
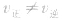 时,平衡便会发生移动而使各组分的浓度、百分含量发生变化,直至建立新的平衡。
时,平衡便会发生移动而使各组分的浓度、百分含量发生变化,直至建立新的平衡。化学平衡状态的判断:
1.
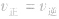 指的是同一物质的正反应速率与逆反应速率相等。
指的是同一物质的正反应速率与逆反应速率相等。 2.反应混合物中各组分的含量(质量分数、体积分数、物质的量分数)保持不变。
3.反应类型分析对于密闭容器中的反应
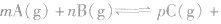 qD(g),根据对化学平衡概念的理解,判断下列各情况是否达到平衡。
qD(g),根据对化学平衡概念的理解,判断下列各情况是否达到平衡。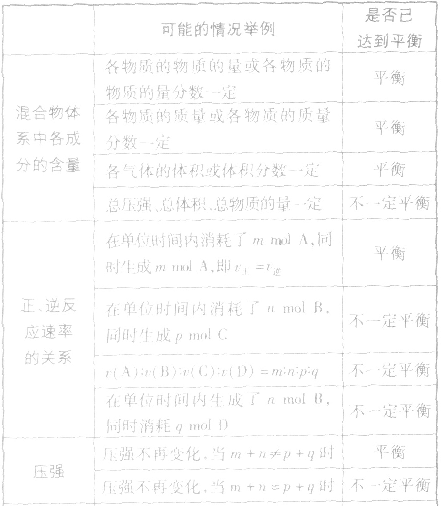

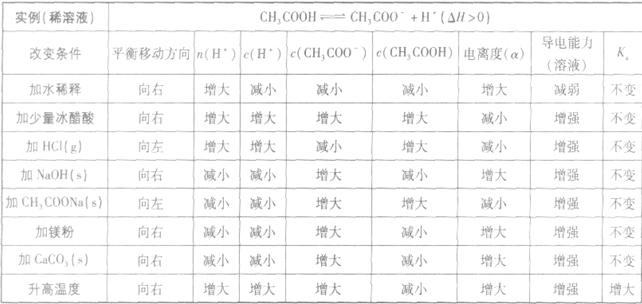
(1)温度:由于弱电解质的电离是吸热过程,故升高温度,将使弱电解质的电离平衡向电离方向移动。
(2)浓度:对于同一弱电解质来说,浓度越小,离子相互碰撞结合成分子的机会越小,弱电解质的电离程度就越大。因此,加水稀释溶液会使弱电解质的电离平衡向电离的方向移动,电离程度增大,电离出的离子的总量增加,但离子浓度是减小的。
(3)同离子效应:加入与弱电解质具有相同的离子的强电解质则抑制弱电解质的电离。
(4)化学反应:在弱电解质溶液中加入能与弱电解质电离产生的某种离子反应的物质,可促进弱电解质的电离。
以醋酸归纳为例:
与“化学中常用图象直观地描述化学反应的进程或结果。下列图象描...”考查相似的试题有:
- T℃时,A气体与B气体反应生成C气体。反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1℃和T2℃时,B...
- (10分)科学家通过不断地努力,找到了CO合成甲醇的新方法.CO和在443K~473K温度下钴作催化剂,可生成碳原子数为5~8的烷烃...
- 反应CH3OH ( l )+ NH3( g ) = CH3NH2( g ) + H2O ( g )在某温度自发向右进行,若反应|ΔH|= 17kJ/mol,|ΔH—TΔS|= 17kJ/mol...
- 在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数...
- 将一定量的氨基甲酸铵固体置于某容积恒定的真空容器中,发生反应:H2NCOONH4(s)2NH3(g)+CO2(g),在不同温度下,该反应达平衡...
- 在某一密闭容器中,充入一定量的HI气体,发生反应2HI(g)H2(g)+I2(g);△H>0,在t1时达到平衡,t2时加热升温并保温,到t3时又...
- 下列不能用勒沙特列原理解释的是A.用排饱和食盐水法收集Cl2B.棕红色NO2加压后颜色先变深后变浅;C.打开汽水瓶时,有大量气...
- 在T℃条件下,向1L固定体积的密闭容器M中加入2 mol X和1 mol Y,发生如下反应: 2X(g) + Y(g)a Z(g) + W(g) △H = -Q ...
- 在一定温度下,向a L密闭容器中加入1mol X气体和 2mol Y气体,发生如下反应:X(g)+2Y(g)2Z(g),此反应达到平衡的标志是 ( )A...
- 下列溶液中微粒浓度关系一定正确的是A.将pH=5的H2SO4溶液稀释1×103后,c(H+):c(SO42-)=2:1B.醋酸与醋酸钠的的混合溶液中:c(C...