本试题 “我国自行研制的优质磷酸二氢钾(KDP)晶体被应用于大功率固体激光器中。现以氯化钾和磷酸为原料制取磷酸二氢钾,反应方程式为 H3PO4(aq) + KCl(aq)KH2PO4(aq)...” 主要考查您对单质磷及其化合物
工业生产其他物质(工业制备碳酸锂,硫酸钡等化工原理)
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 单质磷及其化合物
- 工业生产其他物质(工业制备碳酸锂,硫酸钡等化工原理)
磷在自然界中的存在:
自然界中没有游离态的磷,磷主要以磷酸盐的形式存在于矿石中。磷和氮一样,是构成蛋白质的成分之一。动物的骨骼、牙齿和神经组织,植物的果实和幼芽,生物的细胞里都含有磷,磷对维持生物体正常的生理机能起着重要的作用。
磷的物理性质:
磷的单质有多种同素异形体,其中常见的是白磷和红磷。白磷和红磷的主要性质如下表。 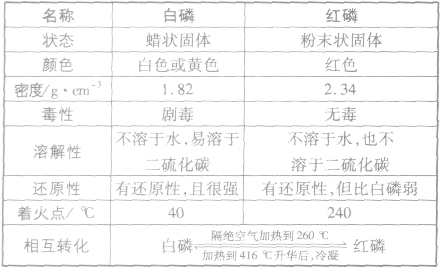
特别提醒白磷遇光会逐渐变为黄色。因此,白磷又称黄磷,白磷的颜色往往表述为“白色或黄色”。
白磷和红磷的化学性质:
白磷和红磷都能在空气或氧气中燃烧,燃烧产物一般是五氧化二磷,且反应放出大量的热,4P+5O2 2P2O5
2P2O5
磷的用途:
白磷和红磷有许多用途,如都可用于制造纯度较高的磷酸;白磷可用于制造燃烧弹、烟幕弹等;红磷可用于制农药、安全火柴等。
白磷和红磷的分子结构:
白磷的分子组成为P4,分子的空间构型为正四面体(如图A)。红磷的结构较复杂,有人认为红磷是P4分子断裂一个键后相互结合形成的长链状分子(如图B).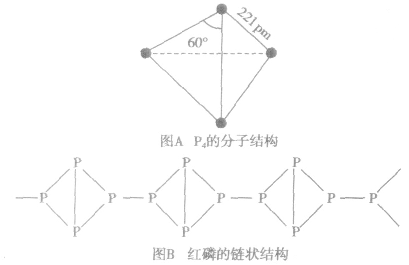
特别提醒白磷和红磷的化学式通常都写为P。
磷的化合物:
(1)五氧化二磷:
五氧化二磷的分子式为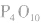 ,通常写为
,通常写为 ,
,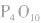 分子的空间构型如图所示。
分子的空间构型如图所示。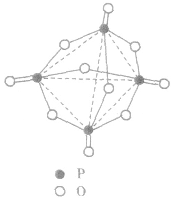
五氧化二磷通常为白色固体,由磷在空气中燃烧生成, 632K时升华。
五氧化二磷是典型的酸性氧化物,具有酸性氧化物的通性。
五氧化二磷很易跟水反应,跟冷水反应生成偏磷酸,跟热水反应生成磷酸,反应放出大量的热。 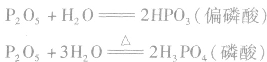
五氧化二磷的强亲水性决定了它可用作干燥剂。五氧化二磷是一种固态、酸性、无强氧化性的干燥剂,干燥能力非常强。
(2)磷酸:
磷酸为三元中强酸,属于弱电解质,易溶于水,在水中分三级电离。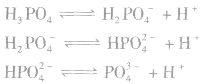
纯磷酸是无色晶体,熔点为315K.沸点较高,可溶于水。
磷酸无强氧化性,具有酸的通性。为了避免Br-、 I-被氧化,可用浓磷酸代替浓硫酸在实验室中制备HBr和HI。
(3)磷酸盐:
磷酸是三元酸,对应的盐有正盐和酸式盐: 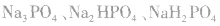 .
.
1.确定化工生产的最佳过程
确定化工生产反应原理与过程的一般方法:对于某一具体的化工产品,研究生产过程要从产品的化学组成和性质考虑,来确定原料和生产路线。
①分析产品的化学组成,据此确定生产产品的主要原料;
②分析产品与生产原料之间关键元素的性质,确定主要生产步骤;
③分析生产原料的性质.确定反应原理。
2.选择化工生产的最佳原料
选择原料首先要考虑化学反应原理,此外还要考虑厂址选择、原料供应、能源供应、工业用水供应、产品存储、产品运输、产品预处理成本、环境保护等。
3.控制最佳化学反应条件
控制反应条件是取得化工生产最佳综合效益的重要环节之一。控制反应条件要应用化学反应速率理论和化学平衡原理,结合具体化学反应的特点以及生产技术和设备条件、能源消耗等,控制最佳化学反应速率和反应物的平衡转化率。
4.科学治理工业“三废”
“三废”主要是指废气、废液和废渣。治理“三废” 首先要从设计生产工艺与选择原料做起,即从源头上解决问题;其次是把好排放关,对排出的“三废”的处理,要尽最大努力使其资源化,最低要求是无害化。
5.充分利用“废热”
通过热交换或其他方式利用化学反应所放出的热量。
硫代硫酸钠的工业制法:
(1)亚硫酸钠
将纯碱溶解后,与(硫磺燃烧生成的)二氧化硫作用生成亚硫酸钠,再加入硫磺沸腾反应,经过滤、浓缩、结晶,制得硫代硫酸钠。
Na2CO3+SO2==Na2SO3+CO2 Na2SO3+S+5H2O==Na2S2O3·5H2O
(2)硫化碱法
利用硫化碱蒸发残渣、硫化钡废水中的碳酸钠和硫化钠与硫磺废气中的二氧化硫反应,经吸硫、蒸发、结晶,制得硫代硫酸钠。
2Na2S+Na2CO3+4SO2==3Na2S2O3+CO2
(3)氧化、亚硫酸钠和重结晶法
由含硫化钠、亚硫酸钠和烧碱的液体经加硫、氧化;亚硫酸氢钠经加硫及粗制硫代硫酸钠重结晶三者所得硫代硫酸钠混合、浓缩、结晶,制得硫代硫酸钠。
2Na2S+2S+3O2==2Na2S2O3 Na2SO3+S==Na2S2O3
(4)重结晶法
将粗制硫代硫酸钠晶体溶解(或用粗制硫代硫酸钠溶液),经除杂,浓缩、结晶,制得硫代硫酸钠。
砷碱法净化气体副产 利用焦炉煤气砷碱法脱硫过程中的下脚(含Na2S2O3),经吸滤、浓缩、结晶后,制得硫代硫酸钠。
高锰酸钾的工业制法:
工业上利用二氧化锰制备高锰酸钾,其步骤是
(1)二氧化锰与氢氧化钾共熔并通入氧气:2MnO2+4KOH+O2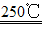 2K2MnO4+2H2O
2K2MnO4+2H2O
(2)电解锰酸钾溶液:2K2MnO4+2H2O 2KMnO4+H2↑+2KOH
2KMnO4+H2↑+2KOH
高锰酸钾常见的制备方法有以下两矿石中取得的二氧化锰和氢氧化钾在空气中或混合硝酸钾(提供氧气)加热,产生锰酸钾,再于碱性溶液中与氧化剂进行电解氧化得到高锰酸钾。 2MnO2+4KOH+O2→2K2MnO4+2H2O 2K2MnO4+Cl2→2KMnO4+2KCl
也可以用MnSO4在酸性环境中和二氧化铅(PbO2)或铋酸钠(NaBiO3)等强氧化剂反应产生。此反应也用于检验二价锰离子的存在,因为高锰酸钾的颜色明显种:
①法一:以MnO2(软锰矿)为原料制KMnO4
第一步:Mn(IV)→Mn(VI) 2MnO2+4KOH+O2====2K2MnO4+2H2O
第二步:CO2歧化K2MnO4 K2MnO4+2CO2====2KMnO4+MnO2+2K2CO3
这种制备方法的最高产率为66.7% 法
②电解法:阳极:2MnO42--2e-→2MnO4- 阴极:2H2O+2e-→H2↑+2OH- 总电解反应方程式为2K2MnO4+2H2O→2KMnO4+2KOH+H2↑
理论产率可达100%
纯硅的制取:
工业上在电炉内,用硅石和碳反应得粗硅和一氧化碳,然后用粗硅和氯气反应得四氯化硅,再用四氯化硅和氢气反应的纯硅和氯化氢,这样就完成硅的制造。(第一步完全相同,第二部有三种方法,工业上用的的是西门子的方法,其他两种不常见。)反应方程式
(1)石英制硅(冶金级),这一步是粗硅制取硅商业上是由高纯度的石英砂和木头,焦炭和煤使用碳棒电极在电弧炉中制得。在高于1900°C的温度下,依照下列方程式碳把石英砂还原成硅: SiO2+C→Si+CO2. SiO2+2C→Si+2CO. 这一过程所的硅称为冶金级硅。纯度为98%-99%。另外,硅制备办法还有熔盐电解法,即电解熔解的二氧化硅。
(2)高纯硅的制备在制备高纯硅之前,需要把粗硅转化成三氯化氢硅(300°C): Si+3HCl→HSiCl3+H2 接着,通过精馏使SiHCl3与其它氯化物分离,经过精馏的SiHCl3,其杂质水平可低于10-10%的电子级硅要求。然后,提纯后的SiHCl3通过CVD原理在1150°C下制备出多晶硅粉。2HSiCl3→Si+2HCl+SiCl4.
与“我国自行研制的优质磷酸二氢钾(KDP)晶体被应用于大功率固体...”考查相似的试题有:
- (共14分)某同学用下列装置(固定、加热仪器和橡胶管略)进行有关氨气制取及其相关实验的探究,回答下列问题.(1)若用装置①...
- 窗体底端窗体顶端下列各组气体,在通常条件下能稳定共存的是( )A.NH3、O2、HCl B.N2、H2、HClC.CO2、NO、O2D.H2S、O2...
- 在一定温度下,某浓度的硝酸与金属锌反应生成NO2和NO的物质的量之比为1∶3,则要使1 mol金属锌完全反应,需要硝酸的物质的量为...
- 下列说法正确的是( )A.通常情况下,氮气的性质不活泼是因为氮元素的非金属性很弱的缘故B.氮气是非极性分子,氨气是极性分...
- (14分)工业上以氨气为原料(铂铑合金网为催化剂)催化氧化法制硝酸的过程如下:(1)已知反应一经发生,铂铑合金网就会处于...
- 采用不同的分类方法,可将非金属氧化物分为不同的类别。例如,从某种意义讲P2O5、SO2、SO3、CO2、Cl2O7等归为一类,则下列氧...
- 试管中盛装的是红棕色气体(可能是两种气体的混合物),当倒扣在盛水的水槽中时,试管内水面上升,但不能充满试管,当试管内鼓...
- 砷为VA族元素,推测其不可能具有的性质是 A.砷在常况下是固体B.砷可以有-3,+3,+5价C.As2O5对应的水化物的酸性比H3PO4强D...
- 将盛有12mLNO2和O2混合气体的量筒倒立于水槽中,充分反应后,还剩余2mL无色气体,则原混合气体中O2的体积可能是( ) A.1.2m...
- 将盛有氮气和二氧化氮混合气体的试管倒立于水中,经足够时间后,试管内气体体积缩小为原体积的3/5,则原混合气体中氮气和二氧...