本试题 “下列排列顺序正确的是( )A.相对分子质量:二氧化碳>氢气>氮气B.铁元素的质量分数:生铁>钢>Fe2O3C.一个分子中所含的原子个数:CH4>NH3>N2D.地壳...” 主要考查您对分子的定义
原子的定义
相对分子质量
地壳中各种元素的含量
合金
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 分子的定义
- 原子的定义
- 相对分子质量
- 地壳中各种元素的含量
- 合金
分子结构图:
由分子构成的物质:
物质是由粒子构成的,构成物质的粒子有多种,分子是其中的一种。世界上许多物质是由分子构成的,分子可以构成单质,也可以构成化合物。如:氧气、氢气、C60等单质是由分子构成的;水、二氧化碳等化合物也是由分子构成的。
分子的定义:
分子是保持物质化学性质的最小粒子。
分子的构成:


由分子构成的物质:
物质是由粒子构成的,构成物质的粒子有多种,分子是其中的一种。世界上许多物质是由分子构成的,分子可以构成单质,也可以构成化合物。如:氧气、氢气、C60等单质是由分子构成的;水、二氧化碳等化合物也是由分子构成的。
分子的定义:
分子是保持物质化学性质的最小粒子。
概念的理解:
①分子是保持物质化学性质的“最小粒子”、不是“唯一粒子”。
②“保持”的含义是指构成该物质的每一个分子与该物质的化学性质是一致的。
③分子只能保持物质的化学物质,而物质的物理性质(如:颜色、状态等)需要大量的集合体一起来共同体现,单个分子无法体现物质的物理性质。
④“最小”不是绝对意义上的最小,而是”保持物质化学性质的最小”。如果不是在“保持物质化学性质” 这层含义上,分子还可以分成更小的粒子。
用分子的观点解释问题:
物理变化和化学变化的区别
由分子构成的物质,发生物理变化时分子本身未变,分子的运动状态、分子间的间隔发生了改变;发生化学变化时分子本身发生了变化,分子分成原子,原子重新组合变成了共他物质的分子。如:水变成水蒸气,水分子本身没有变,只是分子间的问隔变大,这是物理变化;水通直流电.水分子发生了变化,生成了氢原子和氧原子,氢.原子构成氢分子,氧原子构成氧分子,这是化学变化。
分子的表示方法:
分子可用化学式表示:如O:既可表示氧气,也可表示1个氧分子。
分子的构成:

原子结构示意图:
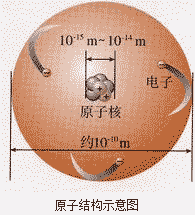
由原子构成的物质:
绝大多数的单质是由原子构成的,如金属单质、稀有气体均是由原子直接构成的,碳、硫、磷等大多数的非金属单质也是由原子直接构成的。
原子的定义:
原子是化学变化中最小的粒子。例如,化学变化中,发生变化的是分子,原子的种类和数目都未发生变化。
对原子的概念可从以下三个方面理解:
①原子是构成物质的基本粒子之一。
②原了也可以保持物质的化学性质,如由原子直接构成的物质的化学性质就由原子保持。
③原子在化学变化中不能再分,是“化学变化中最小的粒子”,脱离化学变化这一条件,原子仍可再分。
原子的性质:
①原子的质量、体积都很小;
②原子在不停地运动;
③原子之间有一定的间隔;
④原子可以构成分子,如一个氧分子是由两个氧原子构成的;也可以直接构成物质,如稀有气体、铁、汞等都是由原子直接构成的;
⑤化学反应中原子不可再分。
原子的表示方法—元素符号:
原子可用元索符号表示:如O既可表示氧元素,也可表示1个氧原子。
分子和原子的联系与区别:
道尔顿的原子模型:
英国自然科学家约翰·道尔顿将古希腊思辨的原子论改造成定量的化学理论,提出了世界上第一个原子的理论模型。他的理论主要有以下四点:
①所有物质都是由非常微小的、不可再分的物质微粒即原子组成
②同种元素的原子的各种性质和质量都相同,不同元素的原子,主要表现为质量的不同
③原子是微小的、不可再分的实心球体
④原子是参加化学变化的最小单位,在化学反应中,原子仅仅是重新排列,而不会被创造或者消失。 虽然,经过后人证实,这是一个失败的理论模型,但道尔顿第一次将原子从哲学带入化学研究中,明确了今后化学家们努力的方向,化学真正从古老的炼金术中摆脱出来,道尔顿也因此被后人誉为“近代化学之父”。

由原子构成的物质:
绝大多数的单质是由原子构成的,如金属单质、稀有气体均是由原子直接构成的,碳、硫、磷等大多数的非金属单质也是由原子直接构成的。
原子的定义:
原子是化学变化中最小的粒子。例如,化学变化中,发生变化的是分子,原子的种类和数目都未发生变化。
对原子的概念可从以下三个方面理解:
①原子是构成物质的基本粒子之一。
②原了也可以保持物质的化学性质,如由原子直接构成的物质的化学性质就由原子保持。
③原子在化学变化中不能再分,是“化学变化中最小的粒子”,脱离化学变化这一条件,原子仍可再分。
原子的性质:
①原子的质量、体积都很小;
②原子在不停地运动;
③原子之间有一定的间隔;
④原子可以构成分子,如一个氧分子是由两个氧原子构成的;也可以直接构成物质,如稀有气体、铁、汞等都是由原子直接构成的;
⑤化学反应中原子不可再分。
原子的表示方法—元素符号:
原子可用元索符号表示:如O既可表示氧元素,也可表示1个氧原子。
分子和原子的联系与区别:
| 项目 | 分子 | 原子 | |
| 不同点 | 本质区别 | 在化学反应中可以分成原子 | 在化学反应中不能再分 |
| 构成物质情况 | 大多数物质由分子构成 | 原子也能直接构成物质,但分子是由原子构成的 | |
| 相同点 | ①质量和体积都很小 ②都在不停地运动 ③粒子间有间隔 ④都是构成物质的粒子 ⑤同种粒子性质相同,不同种粒子性质不同 | ||
| 注意事项 | ①分子是保持物质化学性质的最小粒子 ②原子是化学变化中的最小粒子 ③分子是由原子构成的 ④对于由原子直接构成的物质,原子是保持其化学性质的最小粒子 | ||
| 联系 | 分子是由原子构成的,分子,原子都是构成物质的粒子,它们的关系是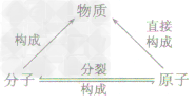 | ||
道尔顿的原子模型:
英国自然科学家约翰·道尔顿将古希腊思辨的原子论改造成定量的化学理论,提出了世界上第一个原子的理论模型。他的理论主要有以下四点:
①所有物质都是由非常微小的、不可再分的物质微粒即原子组成
②同种元素的原子的各种性质和质量都相同,不同元素的原子,主要表现为质量的不同
③原子是微小的、不可再分的实心球体
④原子是参加化学变化的最小单位,在化学反应中,原子仅仅是重新排列,而不会被创造或者消失。 虽然,经过后人证实,这是一个失败的理论模型,但道尔顿第一次将原子从哲学带入化学研究中,明确了今后化学家们努力的方向,化学真正从古老的炼金术中摆脱出来,道尔顿也因此被后人誉为“近代化学之父”。
定义:
相对分子质量就是化学式中各原子的相对原子质量的总和,符号为Mr。如化学式为AmBn的物质的相对分子质量Mr=A的相对原子质量×m+B的相对原子质量×n。
易错易混点:
①化学式中原子团右下角的数字表示其个数(但BaSO4中的4表示氧原子的个数.不表示原子团 SO42-的个数),计算时先求一个原子团的相对质量,再乘以其个数。如Ca(OH)2的相对分子质量=40+(1+16)× 2=74;
②化学式中的圆点,如“CuSO4·5H2O”中的“·” 表示和,不表示积。即CuSO4·5H2O的相对分子质量CuSO4的相对分子质量+H2O的相对分子量×5=160+18×5=250;
③相对分子质量的单位为1,书写时省略不写;
④计算多个相同分子的相对分子质量总和时,应先求出化学式的相对分子质量再乘以前面的系数,如2KClO,的相对分子质量=2×(39+35.5+16×3) =245;
⑤若已知化合物中某原子的相对原子质量A和原了个数n及其质量分数x%,则化合物的相对分子质量=
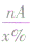
地壳中的元素分布:
地壳是由沙、黏土、岩石等组成的,其中含量最多的是氧元素,含量排在第二位至第五位的元素依次是硅、铝、铁、钙等。地壳中含量最高的非金属元素是氧元素;地壳中含量最高的金属元素是铝元素。(关键记清地壳中含量最高的前四位元素)
海水中元素分布:
海水中的元素分布海洋约占地球表面的70%左右,海水中的元素含量分布如下表所示。其中含量最多的是氧元素。其次是氢元素,这两种元素约占总量的96.5%。
人体中元素分布:
水占人体体重的70%左右。组成人体的元素中含最最多的是氧元索,其次是碳、氢、氮元素。碳,氢、氮三种元素在地壳中的含量较少,但却是生命的必需元素。
地壳是由沙、黏土、岩石等组成的,其中含量最多的是氧元素,含量排在第二位至第五位的元素依次是硅、铝、铁、钙等。地壳中含量最高的非金属元素是氧元素;地壳中含量最高的金属元素是铝元素。(关键记清地壳中含量最高的前四位元素)
海水中元素分布:
海水中的元素分布海洋约占地球表面的70%左右,海水中的元素含量分布如下表所示。其中含量最多的是氧元素。其次是氢元素,这两种元素约占总量的96.5%。
| 元素 | O | H | Cl | Na、Mg |
| 质量分数/% | 85.5 | 10.7 | 2.0 | 1.5 |
人体中元素分布:
水占人体体重的70%左右。组成人体的元素中含最最多的是氧元索,其次是碳、氢、氮元素。碳,氢、氮三种元素在地壳中的含量较少,但却是生命的必需元素。
| 元素 | O | C | H | N | Ca | P | S、K |
| 质量分数/% | 65 | 18 | 10 | 3 | 1.5 | 1.0 | 1.5 |
合金的概念:
合金是在金属中加热熔合某些金属或非金属形成的具有金属特性的物质。
①合金可以是金属与金属或金属与非金属的混合物,不一定全部由金属组成。
②合金具有金属特性,如导电性、导热性、延展性等。
③合金是几种成分熔合在一起形成的,发生的是物理变化,不是化学变化;合金不是几种成分简单地混合而成的。
④合金中各成分仍保持自己的性质。
合金与组成它们的金属的性质比较:
金属熔合了其他金属或非金属后,不仅组成上发生了变化,其内部结构也发生了改变,从而引起性质的变化。因而合金比纯金属具有更广泛的用途。 纯金属与合金性质的比较:
①合金一般比其组分金属的颜色更鲜艳。
②合金的硬度一般应工组成它的金属。
③合金的熔点一般低于成它的金属。
④合金的抗腐蚀能力一般强工组成它的金属。
⑤合金的导电性、导热隆能一般差于组成它的金属。
生铁和钢的比较:
知识点拨:
①生铁和熟铁:生铁是指含碳债在 2%一4.3%之间的铁合金,熟铁是用生铁精炼而成的较纯的铁,含碳量低于0.02%。
②生铁与铸铁:铸铁是生铁中的一种,是指可用来铸造的生铁,通常指球墨铸铁。
③碳素钢的性能与含碳址有关,含碳量越高,硬度越大,但韧性越差;含碳量越低,韧性越好,但硬度越小。
④纯铁与日常生活中铁的颜色差异日常生活,我们接触的铁一般不是纯铁,而是一些铁的氧化物或含铁的混合物,故我们常见的铁的颜色是黑色的,但它并不是纯铁的颜色,纯铁的颜色是银白色的。
应用广泛的合金:
(1)铁合金:铁合金包括生铁和钢,生铁和钢的主要成分是铁,钢与生铁的各种性能不同,主要是由于二者的含碳量不同。
生铁与钢的种类
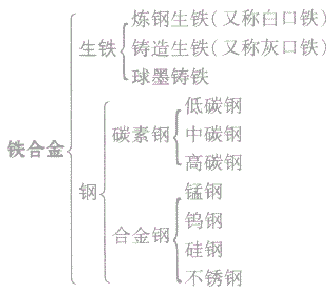
(2)生铁与钢:
生铁的含碳量为2%—4.3%
钢的含碳量为0.03%—2%
(3)钛和钛合金:钛和钛合金被认为是21世纪的重要金属材料。
①性质:优异的耐腐蚀性,对海水、空气和若干腐蚀介质都稳定,可塑性好,强度大,密度小,又称亲生物金属;
②用途:喷气发动机、飞机.机身、人造卫星外壳、火箭壳体、医学补形、人造骨、海水淡化设备、海轮和舰艇的外壳等。
合金是在金属中加热熔合某些金属或非金属形成的具有金属特性的物质。
①合金可以是金属与金属或金属与非金属的混合物,不一定全部由金属组成。
②合金具有金属特性,如导电性、导热性、延展性等。
③合金是几种成分熔合在一起形成的,发生的是物理变化,不是化学变化;合金不是几种成分简单地混合而成的。
④合金中各成分仍保持自己的性质。
合金与组成它们的金属的性质比较:
金属熔合了其他金属或非金属后,不仅组成上发生了变化,其内部结构也发生了改变,从而引起性质的变化。因而合金比纯金属具有更广泛的用途。 纯金属与合金性质的比较:
①合金一般比其组分金属的颜色更鲜艳。
②合金的硬度一般应工组成它的金属。
③合金的熔点一般低于成它的金属。
④合金的抗腐蚀能力一般强工组成它的金属。
⑤合金的导电性、导热隆能一般差于组成它的金属。
生铁和钢的比较:
| 含碳量 | 2%—4% | 0.03%—2% |
| 其他元素 | Si、Mn、S、P(少量) | Si、Mn等 |
| 机械性能 | 硬而脆,无韧性 | 坚硬,韧性大,塑性好,有弹性 |
| 机械加工性质 | 可铸不可锻 | 可铸,可锻,可压延 |
| 分类 | 白口铁,灰口铁,球墨铸铁 | 碳素钢,合金钢 |
知识点拨:
①生铁和熟铁:生铁是指含碳债在 2%一4.3%之间的铁合金,熟铁是用生铁精炼而成的较纯的铁,含碳量低于0.02%。
②生铁与铸铁:铸铁是生铁中的一种,是指可用来铸造的生铁,通常指球墨铸铁。
③碳素钢的性能与含碳址有关,含碳量越高,硬度越大,但韧性越差;含碳量越低,韧性越好,但硬度越小。
④纯铁与日常生活中铁的颜色差异日常生活,我们接触的铁一般不是纯铁,而是一些铁的氧化物或含铁的混合物,故我们常见的铁的颜色是黑色的,但它并不是纯铁的颜色,纯铁的颜色是银白色的。
应用广泛的合金:
(1)铁合金:铁合金包括生铁和钢,生铁和钢的主要成分是铁,钢与生铁的各种性能不同,主要是由于二者的含碳量不同。
生铁与钢的种类

(2)生铁与钢:
生铁的含碳量为2%—4.3%
钢的含碳量为0.03%—2%
(3)钛和钛合金:钛和钛合金被认为是21世纪的重要金属材料。
①性质:优异的耐腐蚀性,对海水、空气和若干腐蚀介质都稳定,可塑性好,强度大,密度小,又称亲生物金属;
②用途:喷气发动机、飞机.机身、人造卫星外壳、火箭壳体、医学补形、人造骨、海水淡化设备、海轮和舰艇的外壳等。
发现相似题
与“下列排列顺序正确的是( )A.相对分子质量:二氧化碳>氢气...”考查相似的试题有:
- 不同种元素间的本质区别是它们的原子含有不同的A.质子数B.最外层电子数C.电子层数D.中子数
- 请用所学化学知识解释下列原理.(1)油锅着火,可用锅盖灭,其灭火的原理是什么?______(2)用过氧化氢制氧气,常加入少量...
- 第三单元中我们学习了很多概念,对于概念我们要在理解的基础上进行运用.(1)由于______是保持物质化学性质的最小粒子,所以...
- 锶原子的相对原子质量为88,其质子数为38,则中子数为( )A.38B.50C.88D.126
- 下列关于原子的叙述正确的是[ ]A.物质都是由原子直接构成的B.原子是由质子和电子构成的C.原子是由质子和中子构成的D.原子...
- 下列有关分子、原子、离子说法正确的是( )A.原子是最小的微粒是不可再分的B.一切原子的原子核都是由质子、中子构成的C....
- 下列有关原子的说法中,正确的是( )A.所有原子的原子核都是由质子和中子构成的B.由于原子中的质子所带的正电荷总量等于电...
- 尿素是一种常见的氮肥,化学式为 CO(NH2)2.计算:(1)尿素的相对分子质量.(2)尿素中各元素的质量比;(3)尿素中氮元...
- 乙烯(化学式是C2H4)是最简单的烯烃,根据所学知识推测下列说法错误的是( )A.乙烯易溶于水B.乙烯是有机物C.乙烯具有可...
- 下列说法正确的是( )A.地壳中含量最多的金属元素是铁B.氯化钠是氯化钠分子构成的C.稀有气体通电时能发出有色的光D.氧气...