本试题 “现有盐酸和CaCl2的混合溶液,向其中逐滴加入过量某物质X,溶液的pH随滴入X的量的变化关系如图所示.则X是( )A.水B.澄清石灰水C.纯碱溶液D.稀盐酸” 主要考查您对酸的性质
溶液的酸碱性与pH值
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 酸的性质
- 溶液的酸碱性与pH值
定义:
化学上是指在溶液中电离时阳离子完全是氢离子的化合物。
酸的通性:
(1)跟指示剂反应 紫色石蕊试液遇酸变红色无色酚酞试液遇酸不变色
(2)跟活泼金属(金属活动性顺序表中比氢强的金属)发生置换反应酸+金属=盐+氢气 例:2HCl+Fe=FeCl2+H2↑
(3)跟碱性氧化物反应酸+碱性氧化物→盐+水 3H2SO4+Fe2O3=Fe2(SO4)3+3H2O
(4)跟某些盐反应酸+盐→新酸+新盐 H2SO4+BaCl2=2HCl+BaSO4↓
(5)跟可溶性碱发生中和反应酸+碱→盐+水 2HCl+Ba(OH)2=BaCl2+2H2O
常见酸的性质:
(1)盐酸是氯化氢的水溶液,是一种混合物。纯净的盐酸是无色的液体,有刺激性气味。
工业浓盐酸因含有杂质(Fe3+)带有黄色。浓盐酸具有挥发性,打开浓盐酸的瓶盖在瓶口
立即产生白色酸雾。这是因为从浓盐酸中挥发出来的氯化氢气体跟空气中水蒸汽接触,形
成盐酸小液滴分散在空气中形成酸雾。
(2)硫酸是一种含氧酸,对应的酸酐是SO3。纯净的硫酸是没有颜色、粘稠、油状的液体,不易挥发。稀H2SO4具有酸的通性。浓硫酸除去具有酸的通性外,还具有三大特性:
①吸水性: 浓H2SO4吸收水形成水合硫酸分子(H2SO4·nH2O),并放出大量热,所以浓硫酸通常用作干燥剂。
②脱水剂: 浓硫酸可将有机化合物中的氢原子和氧原子按水分子的构成(H:O=2:1)夺取而使有机物脱水碳化。纸、木柴、衣服等遇浓硫酸变黑,这就是因为浓硫酸的脱水性使其碳化的缘故。
③强氧化性:
在浓硫酸溶液中大量存在的是H2SO4分子而不是H+,H2SO4分子具强氧化性。
浓硫酸可使金属活动性顺序表氢后面的一些金属溶解,可将C、S等非金属单质氧化,而浓硫酸本身还原成SO2。但是,冷的浓硫酸不能与较活泼的金属Fe和Al反应。原因是浓硫酸可以使Fe和Al的表面形成一层致密的氧化物薄膜,阻止了里面的金属与浓硫酸继续反应,这种现象在化学上叫钝化。由于浓硫酸有脱水性和强氧化性,我们往蔗糖上滴加浓硫酸,会看到蔗糖变黑并且体积膨胀。又由于浓硫酸有吸水性,浓盐酸有挥发性,所以,往浓盐酸中滴加浓硫酸会产生大量酸雾,可用此法制得氯化氢气体。
(3)硝酸也是一种含氧酸,对应的酸酐是N2O5,而不是NO2。
纯净的硝酸是无色的液体,具有刺激性气味,能挥发。打开浓硝酸的瓶盖在瓶口会产生白色酸雾。浓硝酸通常带黄色,而且硝酸越浓,颜色越深。这是因为硝酸具有不稳定性,光照或受热时分解产生红棕色的NO2气体,NO2又溶于硝酸溶液中而呈黄色。所以,实验室保存硝酸时要用棕色(避光)玻璃试剂瓶,贮存在黑暗低温的地方。硝酸又有很强的腐蚀性,保存硝酸的试剂瓶不能用橡胶塞,只能用玻璃塞。
硝酸除具有酸的通性外,不管是稀硝酸还是浓硝酸都具有强氧化性。硝酸能溶解除金和铂以外的所有金属。金属与硝酸反应时,金属被氧化成高价硝酸盐,浓硝酸还原成NO2,稀硝酸还原成NO。但是,不管是稀硝酸还是浓硝酸,与金属反应时都没有氢气产生。较活泼的金属铁和铝可在冷浓硝酸中钝化,冷浓硝酸同样可用铝槽车和铁罐车运输和贮存。硝酸不仅能氧化金属,也可氧化C、S、P等非金属。
浓H2SO4为什么能做干燥剂:
因为浓H2SO4有强烈的吸水性,当它遇到水分子后,能强烈地和水分子结合,生成一系列水合物。这些水合物很稳定,不易分解,所以浓H2SO4是一种很好的干燥剂,能吸收多种气体中的水蒸气,实验室常用来干燥酸性或中性气体。如:CO2,SO2,H2,O2可用浓H2SO4干燥,但碱性气体如:NH3不能用浓H2SO4来干燥。
为什么浓H2SO4能用铁槽来运输:
当铁在常温下和浓H2SO4接触时,它的表面能生成一层致密的氧化膜,这层氧化膜能阻止浓H2SO4;对铁的进一步腐蚀,这种现象叫钝化。
活泼金属能置换出浓H2SO4中的氢吗?
稀H2SO4具有酸的通性,活泼金属能置换出酸中的氢。而浓H2SO4和稀H2SO4的性质不同,活泼金属与浓H2SO4反应时,不能生成氢气,只能生成水和其他物质,因为它具有强氧化性。
敞口放置的浓硫酸.浓盐酸.浓硝酸的变化:
胃酸:
在人的胃液里,HCl的溶质质最分数为0.45%— 0.6%,胃酸是由胃底腺的壁细胞分泌的。它具有以下功能:
(1)促进胃蛋白酶的催化作用,使蛋白质在人体内容易被消化,吸收;(2)使二糖类物质如蔗糖、麦芽糖水解;(3)杀菌。
酸的分类和命名
1.酸根据组成中是否含氧元素可以分为含氧酸和无氧酸。如:盐酸(HCl)属于无氧酸,硫酸(H2SO4)、硝酸(HNO3)属于含氧酸。
2.酸还可以根据每个酸分子电离出的H+个数,分为一元酸、二元酸、多元酸。如:每分子盐酸、硝酸溶于水时能电离出一个H+,属于一元酸;每分子硫酸溶于水时能电离出两个H+,属于二元酸。
3.无氧酸一般从前往后读作“氢某酸”。如:HCl读作氢氯酸(盐酸是其俗名),H2S读作氢硫酸。
4.含氧酸命名时一般去掉氢、氧两种元素,读作 “某”酸。如:H2SO4命名时去掉氢、氧两种元素,读作硫酸,H3PO4读作磷酸。若同一种元素有可变价态,一般低价叫“亚某酸”。如:H2SO3读作亚硫酸,HNO2读作亚硝酸。
化学上是指在溶液中电离时阳离子完全是氢离子的化合物。
酸的通性:
(1)跟指示剂反应 紫色石蕊试液遇酸变红色无色酚酞试液遇酸不变色
(2)跟活泼金属(金属活动性顺序表中比氢强的金属)发生置换反应酸+金属=盐+氢气 例:2HCl+Fe=FeCl2+H2↑
(3)跟碱性氧化物反应酸+碱性氧化物→盐+水 3H2SO4+Fe2O3=Fe2(SO4)3+3H2O
(4)跟某些盐反应酸+盐→新酸+新盐 H2SO4+BaCl2=2HCl+BaSO4↓
(5)跟可溶性碱发生中和反应酸+碱→盐+水 2HCl+Ba(OH)2=BaCl2+2H2O
常见酸的性质:
(1)盐酸是氯化氢的水溶液,是一种混合物。纯净的盐酸是无色的液体,有刺激性气味。
工业浓盐酸因含有杂质(Fe3+)带有黄色。浓盐酸具有挥发性,打开浓盐酸的瓶盖在瓶口
立即产生白色酸雾。这是因为从浓盐酸中挥发出来的氯化氢气体跟空气中水蒸汽接触,形
成盐酸小液滴分散在空气中形成酸雾。
(2)硫酸是一种含氧酸,对应的酸酐是SO3。纯净的硫酸是没有颜色、粘稠、油状的液体,不易挥发。稀H2SO4具有酸的通性。浓硫酸除去具有酸的通性外,还具有三大特性:
①吸水性: 浓H2SO4吸收水形成水合硫酸分子(H2SO4·nH2O),并放出大量热,所以浓硫酸通常用作干燥剂。
②脱水剂: 浓硫酸可将有机化合物中的氢原子和氧原子按水分子的构成(H:O=2:1)夺取而使有机物脱水碳化。纸、木柴、衣服等遇浓硫酸变黑,这就是因为浓硫酸的脱水性使其碳化的缘故。
③强氧化性:
在浓硫酸溶液中大量存在的是H2SO4分子而不是H+,H2SO4分子具强氧化性。
浓硫酸可使金属活动性顺序表氢后面的一些金属溶解,可将C、S等非金属单质氧化,而浓硫酸本身还原成SO2。但是,冷的浓硫酸不能与较活泼的金属Fe和Al反应。原因是浓硫酸可以使Fe和Al的表面形成一层致密的氧化物薄膜,阻止了里面的金属与浓硫酸继续反应,这种现象在化学上叫钝化。由于浓硫酸有脱水性和强氧化性,我们往蔗糖上滴加浓硫酸,会看到蔗糖变黑并且体积膨胀。又由于浓硫酸有吸水性,浓盐酸有挥发性,所以,往浓盐酸中滴加浓硫酸会产生大量酸雾,可用此法制得氯化氢气体。
(3)硝酸也是一种含氧酸,对应的酸酐是N2O5,而不是NO2。
纯净的硝酸是无色的液体,具有刺激性气味,能挥发。打开浓硝酸的瓶盖在瓶口会产生白色酸雾。浓硝酸通常带黄色,而且硝酸越浓,颜色越深。这是因为硝酸具有不稳定性,光照或受热时分解产生红棕色的NO2气体,NO2又溶于硝酸溶液中而呈黄色。所以,实验室保存硝酸时要用棕色(避光)玻璃试剂瓶,贮存在黑暗低温的地方。硝酸又有很强的腐蚀性,保存硝酸的试剂瓶不能用橡胶塞,只能用玻璃塞。
硝酸除具有酸的通性外,不管是稀硝酸还是浓硝酸都具有强氧化性。硝酸能溶解除金和铂以外的所有金属。金属与硝酸反应时,金属被氧化成高价硝酸盐,浓硝酸还原成NO2,稀硝酸还原成NO。但是,不管是稀硝酸还是浓硝酸,与金属反应时都没有氢气产生。较活泼的金属铁和铝可在冷浓硝酸中钝化,冷浓硝酸同样可用铝槽车和铁罐车运输和贮存。硝酸不仅能氧化金属,也可氧化C、S、P等非金属。
浓H2SO4为什么能做干燥剂:
因为浓H2SO4有强烈的吸水性,当它遇到水分子后,能强烈地和水分子结合,生成一系列水合物。这些水合物很稳定,不易分解,所以浓H2SO4是一种很好的干燥剂,能吸收多种气体中的水蒸气,实验室常用来干燥酸性或中性气体。如:CO2,SO2,H2,O2可用浓H2SO4干燥,但碱性气体如:NH3不能用浓H2SO4来干燥。
为什么浓H2SO4能用铁槽来运输:
当铁在常温下和浓H2SO4接触时,它的表面能生成一层致密的氧化膜,这层氧化膜能阻止浓H2SO4;对铁的进一步腐蚀,这种现象叫钝化。
活泼金属能置换出浓H2SO4中的氢吗?
稀H2SO4具有酸的通性,活泼金属能置换出酸中的氢。而浓H2SO4和稀H2SO4的性质不同,活泼金属与浓H2SO4反应时,不能生成氢气,只能生成水和其他物质,因为它具有强氧化性。
敞口放置的浓硫酸.浓盐酸.浓硝酸的变化:
| 酸的名称 | |||||
| 浓盐酸 | 挥发性 | 变小 | 不变 | 变小 | 变小 |
| 浓硫酸 | 挥发性 | 变小 | 不变 | 变小 | 变小 |
| 浓硝酸 | 吸水性 | 不变 | 变大 | 变大 | 变小 |
胃酸:
在人的胃液里,HCl的溶质质最分数为0.45%— 0.6%,胃酸是由胃底腺的壁细胞分泌的。它具有以下功能:
(1)促进胃蛋白酶的催化作用,使蛋白质在人体内容易被消化,吸收;(2)使二糖类物质如蔗糖、麦芽糖水解;(3)杀菌。
酸的分类和命名
1.酸根据组成中是否含氧元素可以分为含氧酸和无氧酸。如:盐酸(HCl)属于无氧酸,硫酸(H2SO4)、硝酸(HNO3)属于含氧酸。
2.酸还可以根据每个酸分子电离出的H+个数,分为一元酸、二元酸、多元酸。如:每分子盐酸、硝酸溶于水时能电离出一个H+,属于一元酸;每分子硫酸溶于水时能电离出两个H+,属于二元酸。
3.无氧酸一般从前往后读作“氢某酸”。如:HCl读作氢氯酸(盐酸是其俗名),H2S读作氢硫酸。
4.含氧酸命名时一般去掉氢、氧两种元素,读作 “某”酸。如:H2SO4命名时去掉氢、氧两种元素,读作硫酸,H3PO4读作磷酸。若同一种元素有可变价态,一般低价叫“亚某酸”。如:H2SO3读作亚硫酸,HNO2读作亚硝酸。
溶液的酸碱度及表示方法
1. 溶液的酸碱性:溶液呈酸性、碱性或中性,通常用指示剂来测定。
2. 溶液的酸碱度:指溶液酸碱性的强弱程度,即酸碱度是定量表示溶液酸碱性强弱的一种方法.溶液的酸碱度通常用pH表示。
3. pH的范围:0—14
溶液酸碱度和pH值的关系
| 溶液的pH值 | 溶液的酸碱度 |
| <7 | 酸性溶液(pH越小,酸性越强) |
| =7 | 中性溶液 |
| >7 | 碱性溶液(pH越大,碱性越大) |
(2)粗略测定溶液的酸碱度常用pH试纸。
pH的测定方法:
测定溶液pH通常用pH试纸和pH计。其中用pH试纸测定溶液pH的具体操作为:测定时,将pH试纸放在表面皿上,用干净的玻璃棒蘸取被测溶液并滴在pH试纸上,半分钟后把试纸显示的颜色与标准比色卡对照,读出溶液的pH,简记为:“一放、二蘸、三滴、四比”。
改变溶液pH的方法:
溶液的pH实质是溶液中H+浓度或OH-浓度大小的外在表现。改变溶液中H+浓度或OH-浓度,溶液的pH就会发生改变。
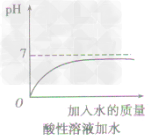
方法一加水:只能改变溶液的酸碱度,不能改变溶液的酸碱性,即溶液的pH只能无限地接近于7。
①向酸性溶液中加水,pH由小变大并接近7,但不会等于7,更不会大于7(如下图所示)。
②向碱性溶液中加水,pH由大变小并接近于7,但不会等于7,更不会小于7(如下图所示)。

方法二加酸碱性相同,pH不同的溶液:原溶液酸碱性不会发生变化,但混合后溶液的pH介于两种溶液之间:
方法三加酸碱性相反的溶液:混合后发生中和反应,溶液的pH可能等于7,若加入的溶液过量,原溶液的酸碱性就会与原来相反(如下图所示)。

pH值测定时的注意事项:
①不能直接把pH试纸浸入待测的溶液中,以免带入杂质,同时还可能溶解pH试纸上的一部分指示剂,致使比色时产生较大误差。
②不能先用水将pH试纸润湿再进行测定。因为将待测溶液滴到用水润湿后的pH试纸上,其溶质质量分数将变小。
③用pH试纸测得溶液的pH一般为整数。
了解溶液的酸碱度的重要意义:
①化工生产中许多反应必须在一定pH溶液里才能进行;
②在农业生产中.农作物一般适宜在pH为7或接近于7的土壤中生长;
③测定雨水的pH(因溶解有二氧化碳,正常雨水的pH约为5.6,酸雨的pH小于5.6),可以了解空气的污染情况;
④测定人体内或排出的液体的pH,可以了解人体的健康状况。
身边一些物质的pH:

发现相似题
与“现有盐酸和CaCl2的混合溶液,向其中逐滴加入过量某物质X,溶...”考查相似的试题有:
- 某同学做了下列实验:①向装有稀硫酸的试管中,滴入紫色石蕊试剂;②向装有稀盐酸的试管中,滴入无色酚酞试剂;③向装有锌粒的试...
- 氧气是无色、无气味的气体,但用氯酸钾与二氧化锰加热分解制得的氧气却有异常气味.将用这种方法制得的氧气通入蒸馏水中,然...
- 铜与浓硫酸共热的条件下可以发生化学反应:Cu+2H2SO4=CuSO4+SO2↑+2H2O,但是在工业上制取硫酸铜不是直接利用浓硫酸与铜反应,...
- 下列变化中,只有加入酸才能一步实现的是( )A.Zn→ZnSO4B.CaCO3→CO2C.Ba(NO3)2→BaSO4D.CuO→CuCl2
- 图表资料可以为我们提供许多信息,下列对图表资料的使用能达到目的的是[ ]A.根据某元素的原子结构示意图推断该元素原子核内...
- 向一定量Ba(OH)2的溶液中加入稀H2SO4溶液,与反应有关的变化关系用下图表示,其中错误的是( )A.B.C.D.
- 向盛有氧化镁、氧化铜和铜粉的混合物中加入过量的稀盐酸,充分反应后过滤,则滤液中含有溶质有______种,滤纸上的物质是______.
- 下列有关酸、碱性质和用途的说法不正确的是[ ]A.氢氧化钠在生活中可用来去除油污,可做炉具清洁剂B.氢氧化钠、氢氧化钙化学性...
- 将混有少量铜的氧化铜粉末加入过量的稀盐酸中,加热后过滤,并将滤液分成两份,试回答:(1)滤纸上的物质是______,滤液的pH...
- 某同学用pH试纸测定日常生活中的一些液体的pH。他的实验记录一定错误的是( )A.肥皂水pH=10B.纯碱溶液pH="11"C.橘子汁pH=...