氧化还原反应的本质:
电子的转移(得失或偏移)
氧化还原反应的特征:
化合价升降(某些元素化合价在反应前后发生变化,是氧化还原反应判别的依据)
氧化还原反应的发展史:
- 物质与氧气发生的反应属于氧化反应,含氧化合物中氧被夺去的反应属于还原反应。
- 有化合价升降的反应属于氧化还原反应。
- 有电子得失或偏移的反应属于氧化还原反应。
对物质的认识存在发展的过程,从最初的隔离开的氧化反应、还原反应,到从表面上看化合价变化的氧化还原反应,把氧化与还原统一在一个概念下,再透过现象看本质,化合价的变化是有电子得失或偏移引起的。
氧化还原反应中应注意的几个问题:
1、氧化剂氧化性的强弱,不是看得电子的多少,而是看得电子的难易;
还原剂还原性的强弱,不是看失电子的多少,而是看失电子的难易。
eg:氧化性:浓HNO3>稀HNO3还原性:Na>Al
2、有新单质参加或生成的反应不一定是氧化还原反应 eg:C(金刚石)==C(石墨);3O2==2O3(放电);P4(白磷)==4P(红磷)
3、任何元素在化学反应中,从游离态变为化合态,或由化合态变为游离态,均发生氧化还原反应(比如置换反应,化合反应,分解反应)
4、置换反应一定是氧化还原反应,复分解反应一定不是氧化还原反应;有单质参加的化合反应和有单质生成的分解反应全部属于氧化还原反应。
5、元素具有最高价的化合物不一定具有强氧化性! eg.H3PO4、H2SiO3(或H4SiO4)两酸均无强氧化性但硝酸有强氧化性。
氧化还原的表示可用单线桥也可用双线桥:
一、双线桥法:
此法不仅能表示出电子转移的方向和总数,还能表示出元素化合价升降和氧化、还原关系。双线桥的箭头始于反应物有关元素的原子或离子,箭头指向发生化合价变化后生成物中对应元素的原子或离子或原子团。
标变价 明确标出所有发生氧化还原反应的元素的化合价,不变价的元素不标化合价。
连双线 将标化合价的同一元素用直线加箭头从反应物指向生成物(注意:箭头的起止一律对准各元素)
标得失 1.标电子转移或偏离数 明确标出得失电子数,格式为“得/失发生氧化还原反应原子个数×单位原子得失电子数”
2.标化合价变化 一律标出化合价的变化,只有“化合价升高”“化合价降低”这两种写法,不可写为“升价”“降价”等
3.标出元素反应类型 一律标出元素所发生的反应,“被氧化”或“被还原”,其余写法均不正确
4.检查得失电子守恒 检查得失电子数是否相等,如不相等则重新分析。
例如: 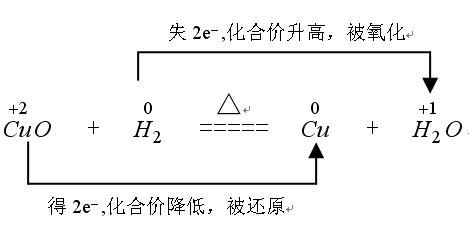
二、单线桥法:
在氧化还原反应中,有电子发生转移(得失或偏移),也就是在反应物中有元素电子发生得失或偏移,这时用一条带箭头的曲线从失去电子的元素指向得到电子的元素,并在“桥”上标出转移的电子数,这种表示方法叫单线桥法。
(1)标价态明确标明发生氧化还原反应的元素的化合价
(2)连单线连接方程式左边的氧化剂与还原剂,箭头一律指向氧化剂
(3)不注得失标出转移的电子的总数,这里不用像双线桥那样,仅需直接标出电子总数
例如: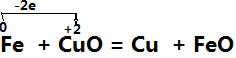
注意事项:
(1)不得标明"得"或"失",否则是错的
(2)箭头表示电子转移的方向,指向氧化剂注意:为了规范起见,单线桥法最好不用于自身氧化还原的反应,因为那样标记会使反应中的电子去向不明确,故在自身氧化还原的反应方程式中最好用双线桥法表示电子转移。
配平简介:
化学反应方程式严格遵守质量守恒定律,书写化学反应方程式写出反应物和生成物后,往往左右两边各原子数目不相等,不满足质量守恒定律,这就需要通过配平来解决。
配平原则:
(1)电子守恒原则:反应中还原剂失去电子的总数与氧化剂得到电子的总数相等
(2)电荷守恒原则:若为离子反应,反应前后离子所带正负电荷总数相等
(3)质量守恒原则:反应前后各元素的原子个数相等
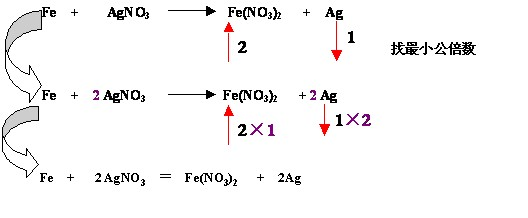
配平步骤: (1)一标:标明反应前后化合价有变化的元素的化合价
(2)二等:通过求最小公倍数使化合价升降总值相等
(3)三定:确定氧化剂与还原剂的化学计量数
氧化剂(还原剂)化学计量数=降(升)价的最小公倍数÷1mol氧化剂(还原剂)降(升)价总数
(4)四平:用观察法配平其他物质的化学计量数
(5)五查:检查质量与电荷、电子是否分别守恒
配平技巧:
(1)逆向配平法:部分氧化还原反应、自身氧化还原反应等可用逆向配平法,即选择氧化产物、还原产物为基准物来配平(一般从反应物很难配平时,可选用逆向配平法)
例:
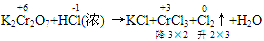
通过表明氧化产物、还原产物化合价的升降,确定CrCl
3、Cl
2的计量数为2和3,然后再用观察法配平。
(2)设“1”配平法:设某一反应物或生成物(一般选用组成元素较多的物质作基准物)的化学计量数为1,其余各物质的化学计量数可根据原子守恒原理列方程求得。
例:P
4O+Cl
2→POCl
3+P
2Cl
6 可令P
4O前的系数为1,Cl
2的系数为x,则
1P4O+xCl
2→POCl
3+3/2P
2Cl
6 ,再由Cl原子守恒得2x=3+3/2×6 得x=6 即可配平
(3)零价配平法:先令无法用常规方法确定化合价的物质中各元素均为零价,然后计算出各元素化合价的升降值,并使元素化合价升降总数相等,最后用观察法配平其他物质的化学计量数。
例:Fe
3C+HNO
3=Fe(NO
3)
3+CO
2↑+NO
2↑+H
2O
复杂化合物Fe
3C按照常规方法分析,无法确定其Fe和C的具体化合价,此时可令组成物质的各元素化合价为零价,根据化合价升降法配平。
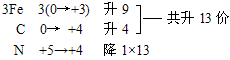
再用观察法确定物质的化学计量数。
(4)整体标价法:当某元素的原子在某化合物中有数个时,可将它作为一个整体对待,根据化合物中元素化合价代数和为零原则予以整体标价。
例:S+Ca(OH)
2→CaS
x+Ca
2S
2O
3+H
2O
生成物CaS
x、Ca
2S
2O
3中的S
x、S
2作为一个整体标价为-2、+4价,则化合价升降关系为:
S
x 0→-2 降2×2
S
2 0→+4 升4×1
即可配平。
(5)缺项配平法:一般先确定氧化剂、还原剂、氧化产物、还原产物的化学计量系数,再通过比较反应物与生成物,确定缺项(一般为H
2O、H
+或OH
-),最后观察配平。
(6)有机氧化还原反应的配平:有机物中元素的化合价一般来讲,氢元素显+1价,氧元素显-2价,然后再根据化合价的代数和为零求酸碳元素的平均化合价。
氧化还原反应方程式配平的一般方法与步骤:
- 一般方法:从左向右配。
- 步骤:标变价,找变化,求总数,配系数。
- 标出元素化合价变化的始态和终态
- 求升价元素或降价元素化合价的变化数
- 求化合价变化数的最小公倍数,分别作为氧化剂或还原剂的系数
- 配平变价元素
- 用观察法配平其他元素
- 检查配平后的方程式是否符合质量守恒定律(离子方程式还要看电荷是否守恒)
如:
特殊技巧:
配平时若同一物质内既有元素的化合价上升又有元素的化合价下降,若从左向右配平较困难,可以采用从右向左配平,成为逆向配平法。
氧化还原反应的表示:
就是表示出反应物中原子或离子间的电子转移的方向和数目。
表示方法:
(1)双线桥法:此法不仅能表示出电子转移的方向和总数,还能表示出元素化合价升降和氧化、还原关系。双线桥的箭头始于反应物有关元素的原子或离子,箭头指向发生化合价变化后生成物中对应元素的原子或离子或原子团。如:

注:箭头表示指向;标“得或失”;箭头表示反应前后变化,不表示电子转移方向
(2)单线桥法:在氧化还原反应中,有电子发生转移(得失或偏移),也就是在反应物中有元素电子发生得失或偏移,这时用一条带箭头的曲线从失去电子的元素指向得到电子的元素,并在“桥”上标出转移的电子数,这种表示方法叫单线桥法。 如:

注:箭头指向;不标“得或失”
双线桥法步骤:
(1)标变价:明确标出所有发生氧化还原反应的元素的化合价,不变价的元素不标化合价。
(2)连双线:将标化合价的同一元素用直线加箭头从反应物指向生成物(注意:箭头的起止要求元素对元素)
(3)标得失:
①标电子转移或偏离数:明确标出得失电子数,格式为“得/失发生氧化还原反应原子个数×单位原子得失电子数”
②标化合价变化:一律标出化合价的变化,只有“化合价升高”“化合价降低”这两种写法,不可写为“升价”“降价”等
③标出元素反应类型:一律标出元素所发生的反应,“被氧化”或“被还原”,其余写法均不正确
④检查得失电子守恒:检查得失电子数是否相等,如不相等则重新分析。
单线桥法步骤:
(1)标价态:明确标明发生氧化还原反应的元素的化合价
(2)连单线:连接方程式左边的氧化剂与还原剂,箭头一律指向氧化剂
(3)不注得失:标出转移的电子的总数,这里不用像双线桥那样,仅需直接标出电子总数
氧化还原反应与基本反应类型的关系:
化合反应有单质参加的是氧化还原反应;分解反应有单质生成的是氧化还原反应;置换反应全部是氧化还原反应;复分解反应都是非氧化还原反应
各反应类型间的关系:

化学反应的分类:
化学反应按照不同的分类标准,可以分成不同的反应类型
- 根据原子(原子团)的组合形式来分类,把化学反应分为化合反应、分解反应、置换反应、复分解反应,
但是四种基本类型的反应并不能包括所有的化学反应,比如3O2==2O3。
- 按是否有电子转移,把化学反应分为氧化还原反应和非氧化还原反应。
- 按是否有离子参加反应,把化学反应分为离子反应和非离子反应。
- 按化学反应的能量关系,把化学反应分为放热反应和吸热反应。
- ……