本试题 “南宁至钦州段的高速铁路正在建设中。请回答下列问题:(1)铁路建设中大量使用了以下材料:①石子;②钢筋水泥柱;③钢轨等,其中钢轨属于______。A.金属材料 B.合...” 主要考查您对置换反应
质量守恒定律
金属的锈蚀与防护
金属材料
酸的用途
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 置换反应
- 质量守恒定律
- 金属的锈蚀与防护
- 金属材料
- 酸的用途
概念:由一种单质和一种化合物反应,生成另一种单质和另一种化合物的反应。
特征:单质+化合物→新单质+新化合物
表达式:A+BC=B+AC
置换反应的规律和发生条件:
特征:单质+化合物→新单质+新化合物
表达式:A+BC=B+AC
置换反应的规律和发生条件:
| 规律 | 发生条件 | 实例 |
| H2+金属氧化物→金属+水 | ①加热 ②K、Ca、Na、Mg、Al等的氧化物除外 |
H2+CuO Cu+H2O Cu+H2O3H2+Fe2O3  2Fe+3H2O 2Fe+3H2O |
| 碳+金属氧化物→金属+CO2 | ①高温 ②K、Ca、Na、Mg、Al等的氧化物除外 |
C+2CuO 2Cu+CO2↑ 2Cu+CO2↑3C+2Fe2O3  4Fe+3CO2↑ 4Fe+3CO2↑ |
| 金属+酸→盐+氢气 | ①浓硫酸,硝酸具有氧化性,和金属反应不生成氢气; ②在金属活动性顺序中排在氢前面的金属才能置换出酸中的氢 |
Zn+2HCl==ZnCl2+H2↑ Zn+H2SO4(稀)==ZnSO4+H2↑ 2Al+3H2SO4(稀)==Al2(SO4)3+3H2↑ |
| 金属+盐→新盐+新金属 | ①盐必须能溶于水 ②在金属活动性顺序表中,排在前面的金属才能置换出后面的金属 ③钾、钙、钠很活泼,与盐溶液反应不能置换出金属 |
Cu+Hg(NO3)2==Hg+Cu(NO3)2 Fe+CuSO4=FeSO4+Cu |
质量守恒定律的概念及对概念的理解:
(1)概念:参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。这个规律就叫做质量守恒定律。
(2)对概念的理解:
①质量守恒定律只适用于化学反应,不能用于物理变化例如,将2g水加热变成2g水蒸气,这一变化前后质量虽然相等,但这是物理变化,不能说它遵守质量守恒定律。
②质量守恒定律指的是“质量守恒”,不包括其他方面的守恒,如对反应物和生成物均是气体的反应来说,反应前后的总质量守恒,但是其体积却不一定守恒。
③质量守恒定律中的第一个“质量”二字,是指“参加”化学反应的反应物的质量,不是所有反应物质量的任意简单相加。
例如,2g氢气与8g氧气在点燃的条件下,并非生成10g水,而是1g氢气与8g氧气参加反应,生成9g水
④很多化学反应中有气体或沉淀生成,因此“生成的各物质质量总和”包括了固态、液态和气态三种状态的物质,不能把生成的特别是逸散到空气中的气态物质计算在“总质量”之外而误认为化学反应不遵循质量守恒定律
质量守恒定律的微观实质:
(1)化学反应的实质在化学反应过程中,参加反应的各物质(反应物) 的原子,重新组合而生成其他物质(生成物)的过程。由分子构成的物质在化学反应中的变化过程可表示为:

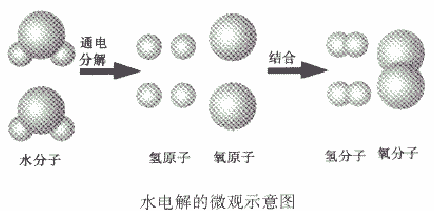
(2)质量守恒的原因在化学反应中,反应前后原子的种类没有改变,数目没有增减,原子本身的质量也没有改变,所以,反应前后的质量总和必然相等。例如,水通电分解生成氢气和氧气,从微观角度看:当水分子分解时,生成氢原子和氧原子,每两个氢原子结合成一个氢分子,每两个氧原子结合成一个氧分子。
质量守恒定律的延伸和拓展理解:
质量守恒定律要抓住“六个不变”,“两个一定变”“两个可能变”。
如从水电解的微观示意图能得出的信息:
①在化学反应中,分子可以分成原子,原子又重新组合成新的分子;
②一个水分子是由两个氢原子和一个氧原子构成的,或一个氧分子由两个氧原子构成、一个氧分子由两个氢原子构成。或氢气、氧气是单质,水是化合物
③原子是化学变化中的最小粒子。
④水是由氢、氧两种元素组成的。
⑤在化学反应,氧元素的种类不变。
⑥在化学反应中,原子的种类、数目不变。
⑦参加反应的各物质的质量总和等于反应后生成的各物质的质量总和。
质量守恒定律的发现:
1. 早在300多年前,化学家们就对化学反应进行定量研究。1673年,英国化学家波义耳(RobertBoyle, 1627-1691)在一个敞口的容器中加热金属,结果发现反应后容器中物质的质量增加了。
2. 1756年,俄国化学家罗蒙诺索夫把锡放在密闭的容器里锻烧,锡发生变化,生成白色的氧化锡,但容器和容器里物质的总质量,在锻烧前后并没有发生变化。经过反复实验,都得到同样的结果,于是他认为在化学变化中物质的质量是守恒的。
3. 1774年,法国化学家拉瓦锡用精确的定量实验法,在密封容器中研究氧化汞的分解与合成中各物质质量之间的关系,得到的结论是:参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。
4. 后来.人们用先进的测址仪器做了大量精度极高的实验,确认拉瓦易的结论是正确的。从此,质量守恒定律被人们所认识。
质量守恒定律的应用:
(1)解释问题
①解释化学反应的本质—生成新物质,不能产生新元素(揭示伪科学的谎言问题)。
②解释化学反应前后物质的质量变化及用质量差确定某反应物或生成物。
(2)确定反应物或生成物的质量
确定反应物或生成物的质量时首先要遵循参加反应的各种物质的质量总量等于生成的各种物质的质量总和;其次各种物质的质量比等于相对分子质量与化学计量数的乘积之比。
(3)确定物质的元素组成
理解在化学反应前后,元素的种类不发生改变。可通过计算确定具体的元素质量。
(4)确定反应物或生成物的化学式
比较反应前后各种原子个数的多少,找出原子个数的差异。但不能忘记化学式前的化学计量数。
(5)确定某物质的相对分子质量(或相对原子质量)
运用质量守恒定律确定某物质的相对分子质量 (或相对原子质量)时,首先寻找两种已知质量的物质,再根据化学方程式中各物质间的质量成正比即可计算得出。注意观察物质化学式前面的化学计量数。
(6)确定化学反应的类型
判定反应的类型,首先根据质量守恒定律判断反应物、生成物的种类和质量(从数值上看,反应物质量减少,生成物质最增加)。如果是微观示意图,要对比观察减少的粒子和增加的粒子的种类和数目再进行判断。
(7)判断化学方程式是否正确
根据质量守恒定律判断化学方程式的对与否关键是看等号两边的原子总数是否相等,同时注意化学式书写是否有误。
(1)概念:参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。这个规律就叫做质量守恒定律。
(2)对概念的理解:
①质量守恒定律只适用于化学反应,不能用于物理变化例如,将2g水加热变成2g水蒸气,这一变化前后质量虽然相等,但这是物理变化,不能说它遵守质量守恒定律。
②质量守恒定律指的是“质量守恒”,不包括其他方面的守恒,如对反应物和生成物均是气体的反应来说,反应前后的总质量守恒,但是其体积却不一定守恒。
③质量守恒定律中的第一个“质量”二字,是指“参加”化学反应的反应物的质量,不是所有反应物质量的任意简单相加。
例如,2g氢气与8g氧气在点燃的条件下,并非生成10g水,而是1g氢气与8g氧气参加反应,生成9g水
④很多化学反应中有气体或沉淀生成,因此“生成的各物质质量总和”包括了固态、液态和气态三种状态的物质,不能把生成的特别是逸散到空气中的气态物质计算在“总质量”之外而误认为化学反应不遵循质量守恒定律
质量守恒定律的微观实质:
(1)化学反应的实质在化学反应过程中,参加反应的各物质(反应物) 的原子,重新组合而生成其他物质(生成物)的过程。由分子构成的物质在化学反应中的变化过程可表示为:

(2)质量守恒的原因在化学反应中,反应前后原子的种类没有改变,数目没有增减,原子本身的质量也没有改变,所以,反应前后的质量总和必然相等。例如,水通电分解生成氢气和氧气,从微观角度看:当水分子分解时,生成氢原子和氧原子,每两个氢原子结合成一个氢分子,每两个氧原子结合成一个氧分子。

质量守恒定律的延伸和拓展理解:
质量守恒定律要抓住“六个不变”,“两个一定变”“两个可能变”。
| 六个不变 | 宏观 | 反应前后的总质量不变 |
| 元素的种类不变 | ||
| 元素的质量不变 | ||
| 微观 | 原子的种类不变 | |
| 原子的数目不变 | ||
| 原子的质量不变 |
| 两个一定变 | 物质的种类一定变 |
| 构成物质的分子种类一定变 |
| 两个可能变 | 分子的总数可能变 |
| 元素的化合价可能变 |
如从水电解的微观示意图能得出的信息:
①在化学反应中,分子可以分成原子,原子又重新组合成新的分子;
②一个水分子是由两个氢原子和一个氧原子构成的,或一个氧分子由两个氧原子构成、一个氧分子由两个氢原子构成。或氢气、氧气是单质,水是化合物
③原子是化学变化中的最小粒子。
④水是由氢、氧两种元素组成的。
⑤在化学反应,氧元素的种类不变。
⑥在化学反应中,原子的种类、数目不变。
⑦参加反应的各物质的质量总和等于反应后生成的各物质的质量总和。
质量守恒定律的发现:
1. 早在300多年前,化学家们就对化学反应进行定量研究。1673年,英国化学家波义耳(RobertBoyle, 1627-1691)在一个敞口的容器中加热金属,结果发现反应后容器中物质的质量增加了。
2. 1756年,俄国化学家罗蒙诺索夫把锡放在密闭的容器里锻烧,锡发生变化,生成白色的氧化锡,但容器和容器里物质的总质量,在锻烧前后并没有发生变化。经过反复实验,都得到同样的结果,于是他认为在化学变化中物质的质量是守恒的。
3. 1774年,法国化学家拉瓦锡用精确的定量实验法,在密封容器中研究氧化汞的分解与合成中各物质质量之间的关系,得到的结论是:参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。
4. 后来.人们用先进的测址仪器做了大量精度极高的实验,确认拉瓦易的结论是正确的。从此,质量守恒定律被人们所认识。
质量守恒定律的应用:
(1)解释问题
①解释化学反应的本质—生成新物质,不能产生新元素(揭示伪科学的谎言问题)。
②解释化学反应前后物质的质量变化及用质量差确定某反应物或生成物。
(2)确定反应物或生成物的质量
确定反应物或生成物的质量时首先要遵循参加反应的各种物质的质量总量等于生成的各种物质的质量总和;其次各种物质的质量比等于相对分子质量与化学计量数的乘积之比。
(3)确定物质的元素组成
理解在化学反应前后,元素的种类不发生改变。可通过计算确定具体的元素质量。
(4)确定反应物或生成物的化学式
比较反应前后各种原子个数的多少,找出原子个数的差异。但不能忘记化学式前的化学计量数。
(5)确定某物质的相对分子质量(或相对原子质量)
运用质量守恒定律确定某物质的相对分子质量 (或相对原子质量)时,首先寻找两种已知质量的物质,再根据化学方程式中各物质间的质量成正比即可计算得出。注意观察物质化学式前面的化学计量数。
(6)确定化学反应的类型
判定反应的类型,首先根据质量守恒定律判断反应物、生成物的种类和质量(从数值上看,反应物质量减少,生成物质最增加)。如果是微观示意图,要对比观察减少的粒子和增加的粒子的种类和数目再进行判断。
(7)判断化学方程式是否正确
根据质量守恒定律判断化学方程式的对与否关键是看等号两边的原子总数是否相等,同时注意化学式书写是否有误。
金属锈蚀:
金属材料受周围介质的作用而损坏,称为金属腐蚀。金属的锈蚀是最常见的腐蚀形态。腐蚀时,在金属的界面上发生了化学或电化学多相反应,使金属转入氧化(离子)状态。这会显著降低金属材料的强度、塑性、韧性等力学性能,破坏金属构件的几何形状,增加零件间的磨损,恶化电学和光学等物理性能,缩短设备的使用寿命,甚至造成火灾、爆炸等灾难性事故。
铁生锈条件的探究
易错点:
①探究铁生锈的条件时采用经煮沸后迅速冷却的蒸馏水,目的是赶走水中溶解的氧气;再加上植物油用来隔绝空气。
②环境中的某些物质会加快铁的锈蚀,如与酸、食盐溶液等接触的铁制品比钢铁生锈更快。
③铁生锈的过程。实际上是铁与空气中的氧气、水蒸气等发生化学反应的过程(缓慢氧化)。反应过程相当复杂,最终生成物铁锈是一种混合物。铁锈(主要成分是Fe2O3·H2O)为红色,疏松多孔,不能阻碍内层的铁继续与氧气、水等反应,因此铁制品可以全部锈蚀。
④许多金属都易生“锈”,但“锈”的结构不同,成分不同。铜在潮湿的空气中也能生“锈”,铜锈即铜绿,其主要成分为碱式碳酸铜[Cu2(OH)2CO3],是铜与水、氧气、二氧化碳共同作用的产物。
金属制品的防锈原理及方法:
(1)防锈原理根据铁的锈蚀条件不难推断出防止铁生锈的方法是使铁制品隔绝空气或隔绝水。
(2)防锈方法:
①保持铁制品表面洁净和干燥,如菜刀不用时擦干放置。
②在钢铁表面覆盖保护膜、如车、船表而涂油漆。
③在钢铁表而镀一层其他金属,如水龙头表面镀铬、镀锌。
④用化学方法使钢铁表面形成致密的保护膜,如烤蓝。
⑤改善金属的结构,如将钢铁制成不锈钢
(3)除锈方法
物理方法:用砂纸打磨,用刀刮。
化学方法:用酸清洗(酸不能过量),发生的反应为:Fe2O3+6HCl==2FeCl3+3H2O或Fe2O3+3H2SO4==Fe2(SO4)3+3H2O。
金属材料受周围介质的作用而损坏,称为金属腐蚀。金属的锈蚀是最常见的腐蚀形态。腐蚀时,在金属的界面上发生了化学或电化学多相反应,使金属转入氧化(离子)状态。这会显著降低金属材料的强度、塑性、韧性等力学性能,破坏金属构件的几何形状,增加零件间的磨损,恶化电学和光学等物理性能,缩短设备的使用寿命,甚至造成火灾、爆炸等灾难性事故。
铁生锈条件的探究
| 实验装置 | 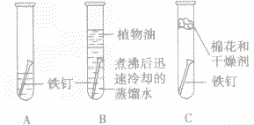 |
| 实验现象 | 几天后观察A试管中铁钉生锈,在水面附近锈蚀 严重,B,C试管中的铁钉没有生锈 |
| 实验分析 | A试管中的铁钉同时跟水、空气(或氧气)接触而生锈; B试管中的铁钉只与水接触不生锈; C 试管中的铁钉只与干燥的空气(或氧气)接触不生锈 |
| 实验结论 | 铁生锈的条件是与水、空气(或氧气)同时接触 |
易错点:
①探究铁生锈的条件时采用经煮沸后迅速冷却的蒸馏水,目的是赶走水中溶解的氧气;再加上植物油用来隔绝空气。
②环境中的某些物质会加快铁的锈蚀,如与酸、食盐溶液等接触的铁制品比钢铁生锈更快。
③铁生锈的过程。实际上是铁与空气中的氧气、水蒸气等发生化学反应的过程(缓慢氧化)。反应过程相当复杂,最终生成物铁锈是一种混合物。铁锈(主要成分是Fe2O3·H2O)为红色,疏松多孔,不能阻碍内层的铁继续与氧气、水等反应,因此铁制品可以全部锈蚀。
④许多金属都易生“锈”,但“锈”的结构不同,成分不同。铜在潮湿的空气中也能生“锈”,铜锈即铜绿,其主要成分为碱式碳酸铜[Cu2(OH)2CO3],是铜与水、氧气、二氧化碳共同作用的产物。
金属制品的防锈原理及方法:
(1)防锈原理根据铁的锈蚀条件不难推断出防止铁生锈的方法是使铁制品隔绝空气或隔绝水。
(2)防锈方法:
①保持铁制品表面洁净和干燥,如菜刀不用时擦干放置。
②在钢铁表面覆盖保护膜、如车、船表而涂油漆。
③在钢铁表而镀一层其他金属,如水龙头表面镀铬、镀锌。
④用化学方法使钢铁表面形成致密的保护膜,如烤蓝。
⑤改善金属的结构,如将钢铁制成不锈钢
(3)除锈方法
物理方法:用砂纸打磨,用刀刮。
化学方法:用酸清洗(酸不能过量),发生的反应为:Fe2O3+6HCl==2FeCl3+3H2O或Fe2O3+3H2SO4==Fe2(SO4)3+3H2O。
定义:
金属材料是指金属元素或以金属元素为主构成的具有金属特性的材料的统称。
常见的金属材料包括:
纯金属、合金、金属材料金属间化合物和特种金属材料等。
(注:金属氧化物(如氧化铝)不属于金属材料)
几种重要的金属:
(1)铁(Fe)
纯铁具有银白色金属光泽,质软,有良好的延展性,是电和热的良导体,密度为7.86g/cm3,属重金属,熔点为1535℃,沸点为2750℃。
(2)铝(Al)
具有银白色金属光泽,密度为2.70g/cm3,熔点为660℃,沸点为2200℃。具有良好的延展性、导电性和一导热性。在空气中,铝表面能形成一层致密的氧化物薄膜,可阻止铝进一步被氧化;铝对浓硝酸等有耐腐蚀性;在高温时还原性很强,可川来冶炼高熔点金属;导电性仅次于银和铜,常用于制造电线和电缆。
(3)铜(Cu)
具有红色金属光泽,密度为8.92g/cm3,熔点为1083℃,沸点为2595℃。具有良好的延展性、导电性和导热性。铜在干燥的空气中化学性质不活泼,在潮湿的空气中,表面可生成碱式碳酸铜(铜绿);导电性在金属中仅次于银,用于制造电线、电缆和各种电器。
(4)锌(Zn)
具有青白色金属光泽,密度为7.14g/cm3,熔点为419.4℃,沸点为907℃.锌在空气中比较稳定,在表面能形成一层致密的氧化物薄膜,所以常将锌镀在铁的表面,以防止铁被腐蚀;锌还常用于电镀、制造铜合金和干电池。
(5)钛(Ti)具有银白色金属光泽,密度为4.5g/cm3,熔点为1725℃,沸点为3260℃。具有良好的延展性和耐腐蚀性。钛和钛的合金可用于制造喷气发动机,轮船外壳,反应器和电信器材。
人类使用金属的历史:
人类最早使用的金属制品是青铜器,然后过渡到铁器时代,再后就是铝制品时代。人类使用金属的历史主要与金属的活动性及冶炼技术的难易有关。
金属之最:
(])地壳中含量最多的金属元素—铝(Al)
(2)人体中含量最高的金属元素—钙(Ca)
(3)导电、导热性最好的金属—银(Ag)
(4)熔点最高的金属—钨(W)
(5)目前世界年产址最高的金属—铁(Fe)
(6)硬度最大的金属—铬(Cr)
(7)密度最大的金属—饿(Os)
(8)密度最小的金属—铿(Li)
金属材料的分类:
金属材料可分为黑色金属材料和有色金属材料。黑色金属材料通常包括铁、铬、锰以及它们的合金,是应用最广泛的金属材料,除黑色金届外其他各种金属称为有色金属。
纯金:
在欧洲和美洲,把纯金叫做“24K","18K”金就是含黄金18份,其余的6份是铜,合为成数,就是七成五。把成数和K数互相折合,可以用下边两个公式:成数÷10×24=K数,K数÷24×10=成数。美国的金元按规定是21.6K,用上面的公式一算,可以知道应该用九成金来铸。普通的金表外壳和金笔尖都是14K,你可以算一算是几成金。
金属材料是指金属元素或以金属元素为主构成的具有金属特性的材料的统称。
常见的金属材料包括:
纯金属、合金、金属材料金属间化合物和特种金属材料等。
(注:金属氧化物(如氧化铝)不属于金属材料)
几种重要的金属:
(1)铁(Fe)
纯铁具有银白色金属光泽,质软,有良好的延展性,是电和热的良导体,密度为7.86g/cm3,属重金属,熔点为1535℃,沸点为2750℃。
(2)铝(Al)
具有银白色金属光泽,密度为2.70g/cm3,熔点为660℃,沸点为2200℃。具有良好的延展性、导电性和一导热性。在空气中,铝表面能形成一层致密的氧化物薄膜,可阻止铝进一步被氧化;铝对浓硝酸等有耐腐蚀性;在高温时还原性很强,可川来冶炼高熔点金属;导电性仅次于银和铜,常用于制造电线和电缆。
(3)铜(Cu)
具有红色金属光泽,密度为8.92g/cm3,熔点为1083℃,沸点为2595℃。具有良好的延展性、导电性和导热性。铜在干燥的空气中化学性质不活泼,在潮湿的空气中,表面可生成碱式碳酸铜(铜绿);导电性在金属中仅次于银,用于制造电线、电缆和各种电器。
(4)锌(Zn)
具有青白色金属光泽,密度为7.14g/cm3,熔点为419.4℃,沸点为907℃.锌在空气中比较稳定,在表面能形成一层致密的氧化物薄膜,所以常将锌镀在铁的表面,以防止铁被腐蚀;锌还常用于电镀、制造铜合金和干电池。
(5)钛(Ti)具有银白色金属光泽,密度为4.5g/cm3,熔点为1725℃,沸点为3260℃。具有良好的延展性和耐腐蚀性。钛和钛的合金可用于制造喷气发动机,轮船外壳,反应器和电信器材。
人类使用金属的历史:
人类最早使用的金属制品是青铜器,然后过渡到铁器时代,再后就是铝制品时代。人类使用金属的历史主要与金属的活动性及冶炼技术的难易有关。
金属之最:
(])地壳中含量最多的金属元素—铝(Al)
(2)人体中含量最高的金属元素—钙(Ca)
(3)导电、导热性最好的金属—银(Ag)
(4)熔点最高的金属—钨(W)
(5)目前世界年产址最高的金属—铁(Fe)
(6)硬度最大的金属—铬(Cr)
(7)密度最大的金属—饿(Os)
(8)密度最小的金属—铿(Li)
金属材料的分类:
金属材料可分为黑色金属材料和有色金属材料。黑色金属材料通常包括铁、铬、锰以及它们的合金,是应用最广泛的金属材料,除黑色金届外其他各种金属称为有色金属。
纯金:
在欧洲和美洲,把纯金叫做“24K","18K”金就是含黄金18份,其余的6份是铜,合为成数,就是七成五。把成数和K数互相折合,可以用下边两个公式:成数÷10×24=K数,K数÷24×10=成数。美国的金元按规定是21.6K,用上面的公式一算,可以知道应该用九成金来铸。普通的金表外壳和金笔尖都是14K,你可以算一算是几成金。
酸的用途很广泛:
1. 盐酸:用于金属表面除锈,制造药物等,人体胃液中含有盐酸帮助消化。
2. 硫酸:用于生产化肥、农药、火药、染料以及冶炼金属、精炼石油等;实验室常用作干燥剂。
3. 硝酸:主要应用于制造化肥,以及硝酸盐工业。
4. 醋酸:生活中既可作食品调味,也可用于清洗热水瓶内水垢。
1. 盐酸:用于金属表面除锈,制造药物等,人体胃液中含有盐酸帮助消化。
2. 硫酸:用于生产化肥、农药、火药、染料以及冶炼金属、精炼石油等;实验室常用作干燥剂。
3. 硝酸:主要应用于制造化肥,以及硝酸盐工业。
4. 醋酸:生活中既可作食品调味,也可用于清洗热水瓶内水垢。
发现相似题
与“南宁至钦州段的高速铁路正在建设中。请回答下列问题:(1)铁路...”考查相似的试题有:
- 电解水生成氢气和氧气的反应为:2H2O2H2↑+O2↑,该反应属于[ ]A.化合反应B.置换反应C.复分解反应D.分解反应
- (1)有两种混合气体A、B,可能分别含有H2、CO和CO2的一种或几种,现将它们分别依次通过足量的下表物质,试完成下表. 混合气...
- 一定质量的某物质充分燃烧,消耗了32g氧气,同时只生成44g二氧化碳和18g水,则该物质中[ ]A.只含有碳元素B.只含有碳、氢两...
- 某学生为探究质量守恒定律,在家中做了灼烧铜丝的家庭小实验.他从家中找来长约30cm的铜芯线,除掉外部包层,将铜丝两端绕成...
- 按要求填下表:化学反应化学方程式问题实验室用氯酸钾和二氧化锰共热制氧气反应物、生成物的物质的量之比氯酸钾:氯化钾:氧...
- 为了减少汽车尾气对空气的污染,在汽车上安装催化转化装置,将有害气体转化为无害物质.其原理为:2CO+2NO2 催化剂 . R+N2,...
- 下列对质量守恒定律理解正确的是( )A.1克红磷在2克氧气中燃烧生成了3克五氧化二磷B.2克氢气和5克氧气完全反应,生成7克水...
- 上海世博会部分场馆的图片如下.图片说明中出现了金属材料的是( )A.“东方之冠”的氟碳涂料B.“阳光谷”的方形钢管C.石油馆...
- 下列关于氢氧化钠的叙述中,不正确的是( )A.固体氢氧化钠要密闭保存B.固体氢氧化钠溶于水吸收热量C.固体氢氧化钠可用作...
- 农村常用的化肥有:NH4HCO3、NH4NO3、KNO3、CO(NH2)2(尿素)、KH2PO4、KCl、Ca(H2PO4)2、NH4H2PO4等,下列化肥属于复合...