本试题 “请你用化学知识解释以下生活中的问题:(1)2007年6月5日,在“南海一号”打捞出的文物中,玉器手镯光彩夺目,铜镜表面有铜绿,铁器锈迹斑斑或荡然无存。写出一...” 主要考查您对置换反应
化学反应方程式的书写
溶液的酸碱性与pH值
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 置换反应
- 化学反应方程式的书写
- 溶液的酸碱性与pH值
概念:由一种单质和一种化合物反应,生成另一种单质和另一种化合物的反应。
特征:单质+化合物→新单质+新化合物
表达式:A+BC=B+AC
置换反应的规律和发生条件:
特征:单质+化合物→新单质+新化合物
表达式:A+BC=B+AC
置换反应的规律和发生条件:
| 规律 | 发生条件 | 实例 |
| H2+金属氧化物→金属+水 | ①加热 ②K、Ca、Na、Mg、Al等的氧化物除外 |
H2+CuO Cu+H2O Cu+H2O3H2+Fe2O3 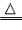 2Fe+3H2O 2Fe+3H2O |
| 碳+金属氧化物→金属+CO2 | ①高温 ②K、Ca、Na、Mg、Al等的氧化物除外 |
C+2CuO 2Cu+CO2↑ 2Cu+CO2↑3C+2Fe2O3  4Fe+3CO2↑ 4Fe+3CO2↑ |
| 金属+酸→盐+氢气 | ①浓硫酸,硝酸具有氧化性,和金属反应不生成氢气; ②在金属活动性顺序中排在氢前面的金属才能置换出酸中的氢 |
Zn+2HCl==ZnCl2+H2↑ Zn+H2SO4(稀)==ZnSO4+H2↑ 2Al+3H2SO4(稀)==Al2(SO4)3+3H2↑ |
| 金属+盐→新盐+新金属 | ①盐必须能溶于水 ②在金属活动性顺序表中,排在前面的金属才能置换出后面的金属 ③钾、钙、钠很活泼,与盐溶液反应不能置换出金属 |
Cu+Hg(NO3)2==Hg+Cu(NO3)2 Fe+CuSO4=FeSO4+Cu |
化学方程式的书写原则遵循两个原则:
一是必须以客观事实为基础,绝不能凭空设想、主观臆造事实上不存在的物质和化学反应;
二是遵循质量守恒定律,即方程式两边各种原子的种类和数目必须相等。
书写化学方程式的具体步骤:
(1)写:根据实验事实写出反应物和生成物的化学式。反应物在左,生成物在右,中间用横线连接,如: H2+O2——H2O,H2O——H2+O2。
(2)配:根据反应前后原子的种类和数目不变的原则,在反应物和生成物的化学式前配上适当的化学计量数,使各种元素的原子个数在反应前后相等,然后将横线变成等号。配平后,化学式前的化学计量数之比应是最简整数比,如:2H2+O2=2H2O,2H2O= 2H2+O2。
(3)注:注明反应条件【如点燃、加热(常用“△”表示)、光照、通电等〕和生成物的状态(气体用“↑”。沉淀用“↓”。)。如:2H2+O2 2H2O,2H2O
2H2O,2H2O 2H2↑+O2↑。
2H2↑+O2↑。
化学计量数:
化学计量数指配平化学方程式后,化学式前面的数字。在化学方程式中,各化学式前的化学计量数之比应是最简整数比,计数量为1时,一般不写出。
书学化学方程式的常见错误:
书写化学方程式时条件和气体、沉淀符号的使用:
(1).“△”的使用
①“△”是表示加热的符号,它所表示的温度一般泛指用酒精灯加热的温度。
②如果一个反应在酒精灯加热的条件下能发生,书写化学方程式时就用“△”,如:2KMnO4 K2MnO4+MnO2+O2↑。
K2MnO4+MnO2+O2↑。
③如果一个反应需要的温度高于用酒精灯加热的温度,一般用“高温”表示;如:CaCO3 CaO+ CO2↑
CaO+ CO2↑
(2)“↑”的使用
①“↑”表示生成物是气态,只能出现在等号的右边。
②当反应物为固体、液体,且生成的气体能从反应体系中逸出来,气体化学式后应该加“↑”。如Fe+ 2HCl==FeCl2+H2↑。
③当反应物是溶液时,生成的气体容易溶于水而不能从反应体系中逸出来,则不用“↑”,如:H2SO4+ BaCl2==FeCl2+2HCl
④只有生成物在该反应的温度下为气态,才能使用“↑”。
⑤若反应物中有气态物质,则生成的气体不用标 “↑”。如:C+O2 CO2
CO2
(3)“↓”使用
①“↓”表示难溶性固体生成物,只能出现在等号的右边
②当反应在溶液中进行,有沉淀生成时,用 “↓”,如:AgNO3+HCl==AgCl↓+HNO3
③当反应不在溶液中进行,尽管生成物有不溶性固体,也不用标“↓”,如:2Cu+O2 2CuO
2CuO
④反应在溶液中进行,若反应物中有难溶性物质,生成物中的难溶性物质后面也不用标“↓”。如:Fe +CuSO4==FeSO4+Cu.
化学方程式中“↑”和“↓”的应用:
①“↑”或“↓”是生成物状态符号,无论反应物是气体还是固体,都不能标“↑”或“↓”;
②若反应在溶液中进行且生成物中有沉淀,则使用“↓”;若不在溶液中进行,无论生成物中是否有固体或难溶物,都不使用“↓”;
③常温下,若反应物中无气体,生成物中有气体.
提取信息书写化学方程式的方法:
书写信息型化学方程式是中考热点,题目涉及社会、生产、生活、科技等各个领域,充分体现了化学学科的重要性,并考查了同学们接受信息、分析问题和解决问题的能力。解答这类题日的关键是掌握好化学方程式的书写步骤,可按两步进行:首先正确书写反应物和生成物的化学式,并注明反应条件及生成物状态;第二步就是化学方程式的配平。
一是必须以客观事实为基础,绝不能凭空设想、主观臆造事实上不存在的物质和化学反应;
二是遵循质量守恒定律,即方程式两边各种原子的种类和数目必须相等。
书写化学方程式的具体步骤:
(1)写:根据实验事实写出反应物和生成物的化学式。反应物在左,生成物在右,中间用横线连接,如: H2+O2——H2O,H2O——H2+O2。
(2)配:根据反应前后原子的种类和数目不变的原则,在反应物和生成物的化学式前配上适当的化学计量数,使各种元素的原子个数在反应前后相等,然后将横线变成等号。配平后,化学式前的化学计量数之比应是最简整数比,如:2H2+O2=2H2O,2H2O= 2H2+O2。
(3)注:注明反应条件【如点燃、加热(常用“△”表示)、光照、通电等〕和生成物的状态(气体用“↑”。沉淀用“↓”。)。如:2H2+O2
 2H2O,2H2O
2H2O,2H2O 2H2↑+O2↑。
2H2↑+O2↑。 化学计量数:
化学计量数指配平化学方程式后,化学式前面的数字。在化学方程式中,各化学式前的化学计量数之比应是最简整数比,计数量为1时,一般不写出。
书学化学方程式的常见错误:
| 常见错误 | 违背规律 |
| 写错物质的化学式 | 客观事实 |
| 臆造生成物或事实上不存在的化学反应 | |
| 写错或漏泄反应条件 | |
| 化学方程式没有配平 | 质量守恒 |
| 漏标多标“↑”、“↓”符号 | —— |
书写化学方程式时条件和气体、沉淀符号的使用:
(1).“△”的使用
①“△”是表示加热的符号,它所表示的温度一般泛指用酒精灯加热的温度。
②如果一个反应在酒精灯加热的条件下能发生,书写化学方程式时就用“△”,如:2KMnO4
 K2MnO4+MnO2+O2↑。
K2MnO4+MnO2+O2↑。 ③如果一个反应需要的温度高于用酒精灯加热的温度,一般用“高温”表示;如:CaCO3
 CaO+ CO2↑
CaO+ CO2↑(2)“↑”的使用
①“↑”表示生成物是气态,只能出现在等号的右边。
②当反应物为固体、液体,且生成的气体能从反应体系中逸出来,气体化学式后应该加“↑”。如Fe+ 2HCl==FeCl2+H2↑。
③当反应物是溶液时,生成的气体容易溶于水而不能从反应体系中逸出来,则不用“↑”,如:H2SO4+ BaCl2==FeCl2+2HCl
④只有生成物在该反应的温度下为气态,才能使用“↑”。
⑤若反应物中有气态物质,则生成的气体不用标 “↑”。如:C+O2
 CO2
CO2 (3)“↓”使用
①“↓”表示难溶性固体生成物,只能出现在等号的右边
②当反应在溶液中进行,有沉淀生成时,用 “↓”,如:AgNO3+HCl==AgCl↓+HNO3
③当反应不在溶液中进行,尽管生成物有不溶性固体,也不用标“↓”,如:2Cu+O2
 2CuO
2CuO ④反应在溶液中进行,若反应物中有难溶性物质,生成物中的难溶性物质后面也不用标“↓”。如:Fe +CuSO4==FeSO4+Cu.
化学方程式中“↑”和“↓”的应用:
①“↑”或“↓”是生成物状态符号,无论反应物是气体还是固体,都不能标“↑”或“↓”;
②若反应在溶液中进行且生成物中有沉淀,则使用“↓”;若不在溶液中进行,无论生成物中是否有固体或难溶物,都不使用“↓”;
③常温下,若反应物中无气体,生成物中有气体.
提取信息书写化学方程式的方法:
书写信息型化学方程式是中考热点,题目涉及社会、生产、生活、科技等各个领域,充分体现了化学学科的重要性,并考查了同学们接受信息、分析问题和解决问题的能力。解答这类题日的关键是掌握好化学方程式的书写步骤,可按两步进行:首先正确书写反应物和生成物的化学式,并注明反应条件及生成物状态;第二步就是化学方程式的配平。
溶液的酸碱度及表示方法
1. 溶液的酸碱性:溶液呈酸性、碱性或中性,通常用指示剂来测定。
2. 溶液的酸碱度:指溶液酸碱性的强弱程度,即酸碱度是定量表示溶液酸碱性强弱的一种方法.溶液的酸碱度通常用pH表示。
3. pH的范围:0—14
溶液酸碱度和pH值的关系
| 溶液的pH值 | 溶液的酸碱度 |
| <7 | 酸性溶液(pH越小,酸性越强) |
| =7 | 中性溶液 |
| >7 | 碱性溶液(pH越大,碱性越大) |
(2)粗略测定溶液的酸碱度常用pH试纸。
pH的测定方法:
测定溶液pH通常用pH试纸和pH计。其中用pH试纸测定溶液pH的具体操作为:测定时,将pH试纸放在表面皿上,用干净的玻璃棒蘸取被测溶液并滴在pH试纸上,半分钟后把试纸显示的颜色与标准比色卡对照,读出溶液的pH,简记为:“一放、二蘸、三滴、四比”。
改变溶液pH的方法:
溶液的pH实质是溶液中H+浓度或OH-浓度大小的外在表现。改变溶液中H+浓度或OH-浓度,溶液的pH就会发生改变。
方法一加水:只能改变溶液的酸碱度,不能改变溶液的酸碱性,即溶液的pH只能无限地接近于7。
①向酸性溶液中加水,pH由小变大并接近7,但不会等于7,更不会大于7(如下图所示)。
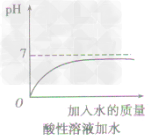
②向碱性溶液中加水,pH由大变小并接近于7,但不会等于7,更不会小于7(如下图所示)。

方法二加酸碱性相同,pH不同的溶液:原溶液酸碱性不会发生变化,但混合后溶液的pH介于两种溶液之间:
方法三加酸碱性相反的溶液:混合后发生中和反应,溶液的pH可能等于7,若加入的溶液过量,原溶液的酸碱性就会与原来相反(如下图所示)。

pH值测定时的注意事项:
①不能直接把pH试纸浸入待测的溶液中,以免带入杂质,同时还可能溶解pH试纸上的一部分指示剂,致使比色时产生较大误差。
②不能先用水将pH试纸润湿再进行测定。因为将待测溶液滴到用水润湿后的pH试纸上,其溶质质量分数将变小。
③用pH试纸测得溶液的pH一般为整数。
了解溶液的酸碱度的重要意义:
①化工生产中许多反应必须在一定pH溶液里才能进行;
②在农业生产中.农作物一般适宜在pH为7或接近于7的土壤中生长;
③测定雨水的pH(因溶解有二氧化碳,正常雨水的pH约为5.6,酸雨的pH小于5.6),可以了解空气的污染情况;
④测定人体内或排出的液体的pH,可以了解人体的健康状况。
身边一些物质的pH:

发现相似题
与“请你用化学知识解释以下生活中的问题:(1)2007年6月5日,在...”考查相似的试题有:
- 请根据下列装置,回答问题:(提示:CO2在饱和碳酸氢钠溶液中几乎不溶)(1)写出标号①②的仪器名称:①______,②______.(2)...
- (10株洲)11.“臭氧(O3)层空洞”是目前全球性环境问题,大气中的臭氧层可吸收紫外线,对地球起保护作用,下列有关臭氧的说法...
- 2010年广州亚运火炬中的燃料X燃烧后不会对环境造成污染,体现了“绿色亚运”的理念。反应的化学方程式为X + 5O2 3CO2+ 4H2O,则...
- 人类的生产和生活都离不开燃料。下面是人类大规模使用燃料的大致顺序:木柴→木炭→煤→石油、天然气。⑴上述燃料中属于化石燃料...
- 下图为某同学探究铁、铜、银三种金属活动性顺序的一组实验:(1)上述实验中,有气泡产生的是A装置,请写出这一反应的化学方...
- 二战期间,为躲避纳粹的迫害,丹麦著名的科学家玻尔,将他钟爱的金制诺贝尔奖章用王水溶解成“金溶液”:Au+HNO3+3HCl=AuCl3+NO...
- 按要求用相应的化学用语填空。(1)少量存在于人的胃液中能帮助消化的是 (2)农业上可用作复合肥料的一种盐是 (3)写出氢氧...
- 下表列出了四种金属元素的原子结构及单质的性质等具体情况:元素名称元素符号原子结构示意图密度g/cm3熔点/℃沸点/℃与冷水反应...
- “雪碧”等碳酸饮料的pH小于7,若晃动后打开瓶盖,其pH将[ ]A.变小B.变大C.不变D.无法确定
- 下列离子组能在pH=1的无色溶液中大量共存的是( )A.NO3- Fe3+ Na+ OH-B.K+ SO42- Na+ NO3-C.Cl-K+ SO42- Ba2+D.Ca2+Cl- ...