本试题 “第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需的能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图(其中12号...” 主要考查您对元素周期表
电离能
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 元素周期表
- 电离能
元素周期表编排原则:
(1)把电子层数相同的各种元素按原子序数递增的顺序从左至右排成横行。
(2)把最外层电子数相同的元素按电子层数递增的顺序由上到下排列成纵行。
注意:①元素周期表是元素周期律的具体表现形式,它反映了元素之间相互联系的规律。
②历史上第一个元素周期表是1869年俄国化学家门捷列夫在前人探索的基础上排成的,他将元素按相对原子质量由小到大依次排列,并将化学性质相似的元素放在一个纵行。
元素周期表的结构:
(1)周期
①周期的含义在元素周期表中,把电子层数相同的元素,按原子序数递增的顺序从左到右排成横行,这样每个横行为一个周期。现在使用的元素周期表有7个横行,即7 个周期。
②周期的划分
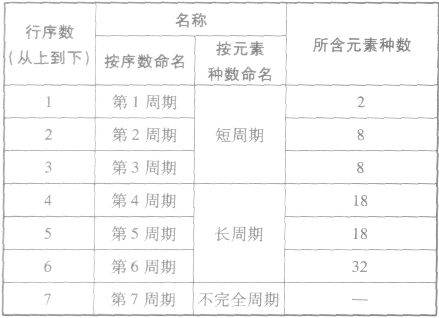
(2)族
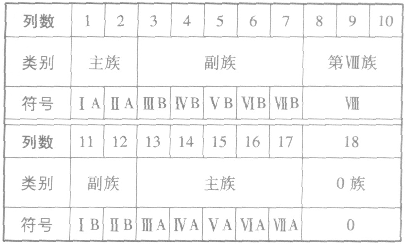
①族的含义在周期表中,把不同横行(即周期)中最外层电子数相同的元素,按电子层数递增的顺序由上到下排成纵行,除第8、9、10三个纵行叫做第Ⅷ族外,其余15个纵行,每个纵行为一族。现在使用的元素周期表有18 个纵行,它们被划分为16个族。
②族的划分
(3)元素周期表中主族元素金属性和非金属性的递变
电离能:
(1)概念
气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量叫做第一电离能。
(2)元素第一电离能的意义:可以衡量元素的原子在气态时失去一个电子的难易程度。第一电离能数值越小,在气态时原子越容易失去一个电子;第一电离能数值越大,在气态时原子越难失去一个电子。
(3)电离能的变化规律
①随核电荷数递增,元素的第一电离能呈周期性变化。
②同一周期内,随着原子序数的增加,原子半径逐渐变小(稀有气体除外),原子核对外层电子的吸引越来越强,元素的原子越来越难失电子,因此元素的第一电离能呈增大的趋势。同一周期内,碱金属元素的第一电离能最小,稀有气体元素的第一电离能最大。
③同一主族,从上到下,随着原子序数的增加,电子层数逐渐增多,原子半径逐渐增大,原子核对外层电子的吸引越来越弱,元素的原子越来越易失电子,故同一主族,随着电子层数的增加,元素的第一电离能逐渐减小。注意通常ⅡA族元素的第一电离能大于ⅢA 族元素、VA族元素的第一电离能大于ⅥA族元素。这是由于ⅡA、VA族元素原子的价电子排布分别为 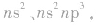 是较稳定的全充满或半充满状态,因而失去电子所需的能量较高。
是较稳定的全充满或半充满状态,因而失去电子所需的能量较高。
与“第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为...”考查相似的试题有:
- 现有3种化合物A、B、C均含短周期元素R,其转化关系如下图所示。(1)若A由第三周期2种元素组成。常温下,0.1 mol/L X溶液的pH=1...
- 下列叙述中,正确的是( )A.IA族元素,其原子半径越大金属性越弱B.核外电子排布相同的两种微粒,化学性质一定相同C.氨基...
- X、Y、Z、D、E、F是原子序数依次增大的六种常见元素。E的单质在Z2中燃烧的产物可使品红溶液褪色。F和Z元素形成的化合物F3Z4具...
- 下列各元素中一定属于主族元素的是[ ]A.X元素能形成+7价的含氧酸及其盐B.Y元素的原子最外层有2个电子C.Z元素的原子最外层电子...
- 下表为元素周期表的一部分,其中的编号代表对应的元素。请回答下列问题:(1)写出元素⑦的基态原子电子排布式:_______________...
- 某元素原子价电子构型3d54s2,其应在[ ]A.第四周期ⅡA族B.第四周期ⅡB族C.第四周期ⅦA族D.第四周期ⅦB族
- 下列元素中非金属性最强的是( )A.氯B.氧C.氟D.溴
- 下列原子各电子层中电子数不合理的是[ ]A.21Sc:K(2) L(8) M(8) N(3)B.24Cr:K(2) L(8) M(13) N(1)C.32Ge:K(2) L(8) M(18...
- 下表是周期表中的一部分,根据A~I在周期表中的位置,选择合适符号并用元素符号或化学式回答下列问题:(1)表中元素,化学性质...
- 下列叙述中正确的是[ ]A.同周期元素中,ⅦA族元素的原子半径最大B.ⅥA族元素的原子,其半径越大,越容易得到电子C.室温时,O...