本试题 “Na2CO3水溶液中存在CO32-+H2O⇌HCO3-+OH-平衡。下列说法不正确的是( ) A.稀释溶液,增大 B.通入CO2,溶液pH减小 C.升高温度,此平衡常数增大 D.加入NaOH...” 主要考查您对盐类水解的定义
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 盐类水解的定义
盐类水解:
1.定义:在水溶液中盐电离出来的离子跟水电离出来的H+或OH-结合生成弱电解质的反应,叫做盐类水解。
2.实质:生成弱电解质,使水的电离平衡被破坏而建立新的平衡。
3.条件:盐中必须有弱酸根离子或弱碱阳离子,盐溶于水。
4.特点:可逆性,写水解离子方程式时要用“ ” 水解是吸热过程,是中和反应的逆过程。一般,水解的程度较小,写离子方程式时,不能用“↑”或“↓”符号。多元弱酸根分步水解,以第一步为主。多元弱碱阳离子一步水解。
” 水解是吸热过程,是中和反应的逆过程。一般,水解的程度较小,写离子方程式时,不能用“↑”或“↓”符号。多元弱酸根分步水解,以第一步为主。多元弱碱阳离子一步水解。
5.规律:有弱才水解,无弱不水解。谁弱谁水解,谁强显谁性。越弱越水解,都弱都水解。例如:25℃时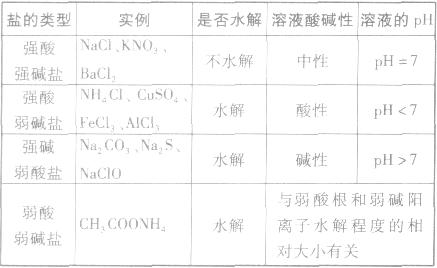
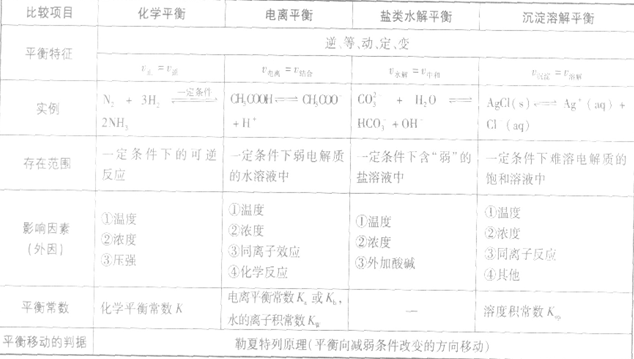
四种重要的动态平衡的比较:
发现相似题
与“Na2CO3水溶液中存在CO32-+H2O⇌HCO3-+OH-平衡。下列说法不正确...”考查相似的试题有:
- (4分)(1)碳酸钾的水溶液蒸干得到的固体物质是________,原因是________________。(2)KAl(SO4)2溶液蒸干得到的固体物...
- 25℃时,将0.01 mol和0.002 mol溶于水,形成1L混合溶液:(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:①_...
- 下列离子因水解相互促进而不能共存的是()A.、Na+、Cl-、OH-B.Al3+、Na+、、C.H+、Fe2+、、Cl-D.、K+、、Al3+
- 现有四瓶丢失标签的NaOH、Na2CO3、AlCl3、NH4HSO4溶液,为鉴别四瓶溶液,将四瓶溶液编号为A溶液、B溶液、C溶液、D溶液进行实...
- 用0.1mol·L—1的盐酸滴定0.1mol·L—1的氨水,在滴定过程中不可能出现的结果是A.c(NH4+)>c(Cl-),c(OH-)>c(H+)B.c(Cl-)...
- 下列过程或现象与盐类水解无关的是A.草木灰不能与铵混合使用态氮肥B.铁在潮湿的环境下生锈C.加热氯化铁溶液颜色变深D.浓...
- (1)氯化铝水溶液呈 性(填“酸性”,“中性”或“碱性”),原因是(用离子方程式表示): 。把AlCl3溶液蒸干,灼烧,最后得到的主...
- 0.1 mol/L K2CO3溶液中,若要使c(CO32-)更接近0.1 mol/L,可采取的措施是A.加入少量盐酸B.加KOH固体C.加水D.加热
- 常温用水稀释0.1mol/l的醋酸钠溶液,溶液中增大的是( )A.[H+]B.[OH-]·[H+]C.[OH-]D.[H+]/[CH3COOH]
- 25℃时,在1.0L浓度均为0.01mol•L-1的某一元酸HA与其钠盐组成的混合溶液中,测得c(Na+)>c(A-),则下列描述中,不正确的是...