本试题 “实验室配制100g 10%的氯化钠溶液时,(1)需要 ______g氯化钠固体.(2)称量时氯化钠应放在托盘天平的 ______盘(选填“左”或“右”).(3)量取水时需要用到 ...” 主要考查您对测容器—量筒
称量器—天平
溶液的配制
关于溶液的计算
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 测容器—量筒
- 称量器—天平
- 溶液的配制
- 关于溶液的计算
概念:
量筒是用来量取液体的一种玻璃仪器。量筒是量度液体体积的仪器。规格以所能量度的最大容量(ml)表示,常用的有10ml、25ml、50ml、100ml、250ml、500ml、1000ml等。外壁刻度都是以ml为单位,10ml量简每小格表示0.2ml,而50ml量筒每小格表示1ml。可见量筒越大,管径越粗,其精确度越小,由视线的偏差所造成的读数误差也越大。所以,实验中应根据所取溶液的体积,尽量选用能一次量取的最小规格的量筒。分次量取也能引起误差。如量取70ml液体,应选用100ml量筒。
量筒的使用:
(1)怎样把液体注入量筒?
向量筒里注入液体时,应用左手拿住量筒,使量筒略倾斜,右手拿试剂瓶,使量筒量筒瓶口紧挨着量筒口,使液体缓缓流入。待注入的量比所需要的量稍少时,把量筒放平,改用胶头滴管滴加到所需要的量。
(2)量筒的刻度应向哪边?
量筒没有“0”的刻度,一般起始刻度为总容积的1/10。不少化学书上的实验图,量筒的刻度面都背着人,这很不方便。因为视线要透过两层玻璃和液体,若液体是浑浊的,就更看不清刻度,而且刻度数字也不顺眼。所以刻度面对着人才好。
(3)什么时候读出所取液体的体积数?
注入液体后,等1~2分钟,使附着在内壁上的液体流下来,再读出刻度值。否则,读出的数值偏小。
(4)怎样读出所取液体的体积数?
应把量筒放在平整的桌面上,观察刻度时,视线与量筒内液体的凹液面的最低处保持水平,再读出所取液体的体积数。否则,读数会偏高或偏低。
(5)量筒能否加热或量取过热的液体?
量筒面的刻度是指温度在20℃时的体积数。温度升高,量筒发生热膨胀,容积会增大。由此可知,量筒是不能加热的,也不能用于量取过热的液体,更不能在量筒中进行化学反应或配制溶液。
(6)从量筒中倒出液体后是否要用水冲洗量筒?
这要看具体情况而定。如果仅仅是为了使测量准确,没有必要用水冲洗量筒,因为制造量筒时已经考虑到有残留液体这一点。相反,如果冲洗反而使所取体积偏大。如果要用同一量筒再量别的液体,就必须用水冲洗干净,为防止杂质的污染。 注:量筒一般只能用于精度要求不很严格时使用,通常应用于定性分析方面,一般不用于定量分析,因为量筒的误差较大。量筒一般不需估读,因为量筒是粗量器,但有时也需估读,如物理电学量器中的电流表,是否估读尚无定论。
(7)关于量筒仰视与俯视的问题:在看量筒的容积时是看水面的中心点,俯视时视线斜向下视线与筒壁的交点在水面上所以读到的数据偏高,实际量取溶液值偏低,仰视是视线斜向上视线与筒壁的交点在水面下所以读到的数据偏低,实际量取溶液值偏高。
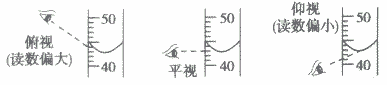
(8)量筒不能直接加热不能在量筒里进行化学反应不能在量筒里配制溶液的原因:
①量筒容积太小,不适宜进行反应
②不能在量筒内稀释或配制溶液,不能对量筒加热,所以不易配制溶液。
③不能在量筒里进行化学反应,以免对量筒产生伤害,有时甚至会发生危险。
④反应可能放热 注意:在量液体时,要根据所量的体积来选择大小恰当的量筒(否则会造成较大的误差),读数时应将量筒垂直平稳放在桌面上,并使量筒的刻度与量筒内的液体凹液面的最低点保持在同一水平面。一般来说量筒是直径越细越好,这样的精确度更高,因为圆形的面积只能计算粗略数,所以直径愈大,误差愈大。
(9)量筒的刻度是从几开始?
最低刻度通常来说是最大刻度的十分之一。比如最大刻度为10mL量筒标准最低刻度1mL,500mL的量筒则最低刻度应为50mL。
解题技巧:
(1)定物量液:是指对某一未知体积的液态物质用量筒量其体积。
例:要量出一杯酒精的体积。方法:
①选择大小合适的量筒。即选用体积略大于一杯酒精灯体积的量筒。
②将烧杯中的酒精倒入量筒中。
③将量筒放平,平视凹液向的最低点,读数即为这杯酒精的体积。若俯视,读数偏高;若仰视,则读数偏低。
(2)定量量液:是指用量筒量取一定体积的某液态物质。例:要量取80mL的水。方法:
①选择100mL的量筒。
②向量筒中倾倒水至接近80mL.刻度线时,改用胶头滴管滴加水至视线在同一水平线上,所量取水的体积即为80mL。若俯视读数,则实际量偏低;若仰视读数,则实际量偏高。
量筒是用来量取液体的一种玻璃仪器。量筒是量度液体体积的仪器。规格以所能量度的最大容量(ml)表示,常用的有10ml、25ml、50ml、100ml、250ml、500ml、1000ml等。外壁刻度都是以ml为单位,10ml量简每小格表示0.2ml,而50ml量筒每小格表示1ml。可见量筒越大,管径越粗,其精确度越小,由视线的偏差所造成的读数误差也越大。所以,实验中应根据所取溶液的体积,尽量选用能一次量取的最小规格的量筒。分次量取也能引起误差。如量取70ml液体,应选用100ml量筒。
量筒的使用:
(1)怎样把液体注入量筒?
向量筒里注入液体时,应用左手拿住量筒,使量筒略倾斜,右手拿试剂瓶,使量筒量筒瓶口紧挨着量筒口,使液体缓缓流入。待注入的量比所需要的量稍少时,把量筒放平,改用胶头滴管滴加到所需要的量。
(2)量筒的刻度应向哪边?
量筒没有“0”的刻度,一般起始刻度为总容积的1/10。不少化学书上的实验图,量筒的刻度面都背着人,这很不方便。因为视线要透过两层玻璃和液体,若液体是浑浊的,就更看不清刻度,而且刻度数字也不顺眼。所以刻度面对着人才好。
(3)什么时候读出所取液体的体积数?
注入液体后,等1~2分钟,使附着在内壁上的液体流下来,再读出刻度值。否则,读出的数值偏小。
(4)怎样读出所取液体的体积数?
应把量筒放在平整的桌面上,观察刻度时,视线与量筒内液体的凹液面的最低处保持水平,再读出所取液体的体积数。否则,读数会偏高或偏低。
(5)量筒能否加热或量取过热的液体?
量筒面的刻度是指温度在20℃时的体积数。温度升高,量筒发生热膨胀,容积会增大。由此可知,量筒是不能加热的,也不能用于量取过热的液体,更不能在量筒中进行化学反应或配制溶液。
(6)从量筒中倒出液体后是否要用水冲洗量筒?
这要看具体情况而定。如果仅仅是为了使测量准确,没有必要用水冲洗量筒,因为制造量筒时已经考虑到有残留液体这一点。相反,如果冲洗反而使所取体积偏大。如果要用同一量筒再量别的液体,就必须用水冲洗干净,为防止杂质的污染。 注:量筒一般只能用于精度要求不很严格时使用,通常应用于定性分析方面,一般不用于定量分析,因为量筒的误差较大。量筒一般不需估读,因为量筒是粗量器,但有时也需估读,如物理电学量器中的电流表,是否估读尚无定论。
(7)关于量筒仰视与俯视的问题:在看量筒的容积时是看水面的中心点,俯视时视线斜向下视线与筒壁的交点在水面上所以读到的数据偏高,实际量取溶液值偏低,仰视是视线斜向上视线与筒壁的交点在水面下所以读到的数据偏低,实际量取溶液值偏高。
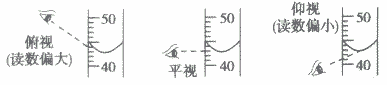
(8)量筒不能直接加热不能在量筒里进行化学反应不能在量筒里配制溶液的原因:
①量筒容积太小,不适宜进行反应
②不能在量筒内稀释或配制溶液,不能对量筒加热,所以不易配制溶液。
③不能在量筒里进行化学反应,以免对量筒产生伤害,有时甚至会发生危险。
④反应可能放热 注意:在量液体时,要根据所量的体积来选择大小恰当的量筒(否则会造成较大的误差),读数时应将量筒垂直平稳放在桌面上,并使量筒的刻度与量筒内的液体凹液面的最低点保持在同一水平面。一般来说量筒是直径越细越好,这样的精确度更高,因为圆形的面积只能计算粗略数,所以直径愈大,误差愈大。
(9)量筒的刻度是从几开始?
最低刻度通常来说是最大刻度的十分之一。比如最大刻度为10mL量筒标准最低刻度1mL,500mL的量筒则最低刻度应为50mL。
解题技巧:
(1)定物量液:是指对某一未知体积的液态物质用量筒量其体积。
例:要量出一杯酒精的体积。方法:
①选择大小合适的量筒。即选用体积略大于一杯酒精灯体积的量筒。
②将烧杯中的酒精倒入量筒中。
③将量筒放平,平视凹液向的最低点,读数即为这杯酒精的体积。若俯视,读数偏高;若仰视,则读数偏低。
(2)定量量液:是指用量筒量取一定体积的某液态物质。例:要量取80mL的水。方法:
①选择100mL的量筒。
②向量筒中倾倒水至接近80mL.刻度线时,改用胶头滴管滴加水至视线在同一水平线上,所量取水的体积即为80mL。若俯视读数,则实际量偏低;若仰视读数,则实际量偏高。
定义:
天平是用于称量物体质量,狭义上也叫托盘天平(实验室中多用托盘天平)。
常用的精确度不高的天平,由托盘、指针、横梁、标尺、游码、砝码、平衡螺母、分度盘等组成。分度值一般为0.1或0.2克。
一种衡器:由支点(轴)在梁的中心支着天平梁而形成两个臂每个臂上挂着一个盘,其中一个盘里放着已知重量的物体另一个盘里放待称重的物体,固定在梁上的指针在不摆动且指向正中刻度时的偏转就指示出待称重物体的重量。

托盘天平的使用方法:
(1)要放置在水平的地方。游码要归零。
(2)调节平衡螺母(天平两端的螺母)调节零点直至指针对准中央刻度线。
(3)左托盘放称量物,右托盘放砝码(左物右码)。根据称量物的性状应放在玻璃器皿或洁净的纸上,事先应在同一天平上称得玻璃器皿或纸片的质量,然后称量待称物质。
(4)添加砝码从估计称量物的最大值加起,逐步减小。托盘天平只能称准到0.1克。加减砝码并移动标尺上的游码,直至指针再次对准中央刻度线。
(5)过冷过热的物体不可放在天平上称量。应先在干燥器内放置至室温后再称(或在特殊器皿中称量)。
(6)物体的质量=砝码重量+游码所显示的度数
(7)取用砝码必须用镊子轻拿轻放,取下的砝码应放在砝码盒中,称量完毕,应把游码移回零点。
(8)称量干燥的固体药品时,应在两个托盘上各放一张相同质量的纸,然后把药品放在纸上称量。
(9)易潮解的药品,必须放在玻璃器皿上(如:小烧杯、表面皿)里称量。
(10)砝码若生锈,测量结果偏小;砝码若磨损,测量结果偏大。
解题技巧:
1、定物称量:是指对某一物质,用托盘天平称量其质量,例如要称出一铁块的质量。
方法:
①先将游码归零,再调节托盘天平左、右的平衡螺母,至平衡。
②在左盘上放铁块。
③向右盘添加砝码,先加质量大的砝码,再加质量小的砝码,最后移动游码,直至天平平衡。砝码和游码的示数和即为铁块的质量。
2、定量称量:是指用托盘天平称量出一定质量的某物质。例如要称量5.5gNaCl。
方法:
①调节托盘天平平衡螺母至天平平衡。
②在左、右两盘各放一张质量相同的纸。
③向右盘添加5g砝码,再移动游码至0.5g处。
④向左盘不断地加入NaCl.
天平的分类:
有狭义和广义之分。
狭义的天平专指双盘等臂机械天平,是利用等臂杠杆平衡原理,将被测物与相应砝码比较衡量,从而确定被测物质量的一种衡器。
广义的天平则包括双盘等臂机械天平、单盘不等臂机械天平和电子天平3类。
双盘等臂机械天平,一般按结构分为普通标牌天平、微分标牌天平和架盘天平3种。
也可按用途分为检定天平、分析天平、精密天平和普通天平4种。
①检定天平:是计量部门、商检部门或其他有关部门或工厂专门用来检查或校准砝码的天平。
②分析天平:是用于化学分析和物质精确衡量的高准确度天平。在大多数情况下,这类天平的最小分度值都小于最大称量的 10-5。分析天平可按衡量范围和最小分度值分为常量天平(称量和最小分度值分别为100~200g和0.01~1mg)、半微量天平(30~100g和1~10g)、微量天平(3~30g和0.1~1g)和超微量天平(3~5g和0.1g以下)。
③精密天平:广泛应用于各种物质的精密衡量,其最小分度值通常为最大称量的10-5~10-4。
④普通天平:用作物质的一般衡量。最小分度值等于或大于最大称量的10-4。
知识梳理:
1 、固体 + 水
①实验步骤:计算—称量—量取—溶解
②实验器材:托盘天平 + 药匙(或镊子) ;合适的量筒 + 胶头滴管;烧杯 + 玻璃棒
③注意事项:计算、称量和量取都要准确,溶解时固体要溶解完全
2 、液体 + 水
①实验步骤:计算—量取—溶解
②实验器材:合适的量筒 + 胶头滴管;烧杯 + 玻璃棒
③注意事项:计算、量取都要准确,同时需要两种不同规格的量筒
配制溶液的步骤:
(1)用溶质和水配制一定溶质质量分数的溶液
①实验用品:托盘天平、烧杯、量筒、胶头滴管、玻璃棒、药匙等。
②实验步骤:
计算→称量药品→量取水→搅拌溶解
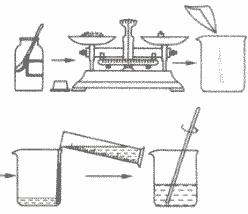
a.计算所需溶质和水的质量;
b.用托盘天平称量所需溶质,倒入烧杯中;
c.把水的密度近似看作1g/cm3,用量筒量取一定体积的水,倒入盛有溶质的烧杯里,用玻璃棒搅拌,使溶质溶解;
d.把配好的溶液装入试剂瓶中,盖好瓶塞并贴上标签(标签中应包括药品的名称和溶液中溶质的质量分数),放到试剂柜中。
③导致溶液质量分数变化的因素
a.称量时物质和砝码的位置放错,如止确称量5.8gNaCl,应在右盘放置5g砝码,再用0.8g游码,若放错位置,将砝码放在天平的左盘,则实际称量NaCl的质量为5g-0.8g=4.2g,这样会导致配制的溶液溶质质量分数变小;
b.量筒量取水的体积时读取示数错误,读取示数时仰视读数所量取水的实际体积大于理论值,将会使配制的溶液溶质质量分数变小;读取示数时俯视读数所量取水的实际体积小于理论值,将会使配制的溶液溶质质量分数变大;
c.将量筒中的水倒入烧杯时洒落到外面或未倒净,将导致溶液溶质质最分数偏大;
d.所用固体不纯,将会导致溶液溶质质量分数偏小;
e.计算错误可能会导致溶液溶质质量分数偏大或偏小。
配制溶液时导致溶质质量分数变化的原因:
在配制一定质量和一定质量分数的溶液过程中,经常会出现所得溶液溶质质量分数偏大或偏小的情况。
1. 所配溶液溶质质量分数偏小的原因:
①从计算错误角度考虑:水的质量算多了,溶质的质量算少了;
②从用托盘大平称量的角度考虑:天平读数有问题。药品和砝码放颠倒了,左盘放纸片但右盘没有放纸片,调零时,游码未拨回“0”刻度等;
③从用量筒量取液体的角度考虑:量取溶剂时,仰视读数了;
④从转移药品角度考虑:烧杯不干燥或烧杯内有水,量筒中的液体溶质未全部倒人烧杯中;
⑤从药品的纯度角度考虑:溶质中含有杂质
2. 所配溶液溶质质量分数偏大的原因
①称量时,所用砝码已生锈或沾有油污;②量取溶剂时,俯视读数了。
综合配制溶液的计算利用:
所提供的信息可选取多种方案配制所需的溶液。如现有KCl固体、蒸馏水、5%的KCl溶液、15%的KCl溶液,配制100g10%的KCl溶液,其方案有:
| 所需药品 | 主要步骤 | |
| 一 | 10gKCl+90g蒸馏水 | 用天平称量10gKCl,用量筒量取90ml水,分别倒入烧杯,用玻璃棒搅拌至KCl固体全部消失 |
| 二 | 66.7g15%的KCl溶液33.3g蒸馏水 | 用量筒量取33.3mL水,用天平称66.7g15%的KCl溶液,混合均匀即可 |
| 三 | 5.3gKCl+94.7g 5%的KCl溶液 | 用天平称量5.3gKCl固体和94.7g 5%的KCl溶液,将5.3gKCl倒入94.7g5%的KCl溶液中,用玻璃棒搅拌至KCl固体全部消失 |
| 四 | 50g5%KCl溶液+50g15%KCl 溶液 | 用天平称量5%、15%的KCl溶液各50g,混合均匀即可 |
溶质质量分数:
1. 概念:溶液中溶质的质量分数是溶质质量与溶液质量之比。
2. 表达式:
溶质质量分数= =
=
3. 含义:溶质质量分数的含义是指每100份质量的溶液中含有溶质的质份为多少。如100g10%的NaCl溶液中含有10gNaCl.。不要误认为是100g水中含有10gNaCl。
应用溶质质量分数公式的注意事项:
①溶质的质量是指形成溶液的那部分溶质,没有进入溶液的溶质不在考虑范围之内。如在20℃时,100g水中最多能溶解36gNaCl,则20gNaCl放入50g 水中溶解后,溶质的质量只能是18g。
②溶液的质量是该溶液中溶解的全部溶质的质量与溶剂的质量之和(可以是一种或几种溶质)。
③计算时质量单位应统一。
④由于溶液的组成是指溶液中各成分在质量方面的关系,因此,对溶液组成的变化来说,某物质的质量分数只有在不超过其最大溶解范围时才有意义。
例如在20℃时,NaCl溶液中溶质的质量分数最大为26.5%,此时为该温度下氯化钠的饱和溶液,再向溶液中加入溶质也不会再溶解,浓度也不会再增大。因此离开实际去讨论溶质质量分数更大的NaCl溶液是没有意义的。
⑤运用溶质质量分数表示溶液时,必须分清溶质的质量、溶剂的质量和溶液的质量。
a.结晶水合物溶于水时,其溶质指不含结晶水的化合物。如CuSO4·5H2O溶于水时,溶质是CuSO4。
溶质质量分数= ×100%
×100%
b.当某些化合物溶于水时与水发生了反应,此时溶液中的溶质是反应后生成的物质。如Na2O溶于水时发生如下反应:Na2O+H2O==2NaOH。反应后的溶质是NaOH,此
溶液的溶质质量分数= 。
。
c.若两种物质能发生反应,有沉淀或气体生成,此时溶液中的溶质质量分数=
影响溶质质量分数的因素:
(1)影响溶质质量分数的因素是溶质、溶剂的质录,与温度、是否饱和无关。在改变温度的过程中若引起溶液中溶质、溶剂质量改变,溶质的质量分数也会改变,但归根结底,变温时必须考虑溶质、溶剂的质量是否改变。因而,影响溶质的质量分数的因素还是溶质、溶剂的质量。例如:
①将饱和的NaNO3溶液降低温度,由于析出品体,溶液中溶质的质缺减少,溶剂的质量不变,所以溶液中溶质的质量分数变小。
②将饱和的NaNO3溶液升高温度,只是溶液变成了不饱和溶液,溶液中溶质、溶剂的质量不变,因而溶液中溶质的质量分数不变。
(2)不要认为饱和溶液变成不饱和溶液,溶质的质量分数就变小;也不要认为不饱和溶液变成饱和溶液,溶质的质量分数就变大;要具体问题具体分析。
有关溶质质量分数计算的类型
(1)利用公式的基本计算
①已知溶质、溶剂的质量,求溶质的质量分数。
直接利用公式:溶质的质量分数= ×100%
×100%
②已知溶液、溶质的质量分数,求溶质、溶剂的质量。
利用公式:溶质的质量=溶液的质量×溶质的质量分数
溶剂的质量=溶液的质量一溶质的质量
③已知溶质的质量、溶质的质量分数,求溶液的质量。
利用公式:溶液的质量=溶质的质量÷溶质的质量分数
④质量、体积、密度与溶质质量分数的换算
当溶液的量用体积表示时,计算时应首先将溶液的体积换算成质量后再进行相关计算。因为计算溶质的质量分数的公式中各种量都是以质量来表示的,不能以体积的数据来代替。
利用公式:溶液的质量=溶液的体积×溶液的密度
(2)溶液的稀释与浓缩
注意:
a.几种溶液混合,溶液的体积不能简单相加,即V总≠VA+VB
b.混合后溶液的质量、溶质的质量可以相加,即m总=mA+mB
c. 要求混合后溶液的总体积,必须依据公式V=m/ρ,所以要知道混合溶液的密度才能求出总体积。
(3)饱和溶液中溶质质量分数的计算
a. 固体溶解度的计算公式
根据固体溶解度的计算公式[溶解度(S)= ×100g]可推导出:
×100g]可推导出: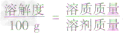 ,
,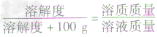
b. 溶解度与溶质质量分数的关系
特殊的溶质质量分数的计算:
(1)结晶水合物溶于水时,其溶质指不含结晶水的化合物。
如CuSO4·5H2O溶于水时,溶质是CuSO4。
溶质质量分数= ×100%
×100%
(2)溶质只能是已溶解的那一部分,没有溶解的不能做溶质计算
如20℃时,20gNaCl投入到50g中水中(20℃时,NaCl的溶解度为36g)。20℃时50g水最多只能溶解18gNaCl,如溶质的质量为18g,而不是20g,所以该NaCl溶液的质量分数=18g/(50g+18g)×100%=26.5%。
(3)当某些化合物溶于水时与水发生了反应,此时溶液中的溶质是反应后生成的物质。如Na2O溶于水时发生如下反应:Na2O+H2O==2NaOH。反应后的溶质是NaOH,此
溶液的溶质质量分数= 。
。
(4)某混合物溶于水,要计算某一溶质的质量分数,溶液的质量包括混合物与水的质量
如5gNaCl和1gKNO3的混合物溶于100g水,计算NaCl的溶质质量分数:
ω(NaCl)=5g/(5g+1g+100g)×100%=4.7%。
(5)利用元素的质量分数进行计算
溶液中溶质的质量分数与溶质中某元素的质量分数之间有着联系。溶液的溶质质量分数×溶质中某元素的质量分数=溶液中某元素的质量分数。
溶质质量分数的不变规律:
(1)从一瓶溶液中不论取出多少溶液,取出溶液及剩余溶液的溶质质量分数与原来溶液中溶质质量分数相同。
(2)溶质、溶质质量分数均相同的两种溶液混合,所得溶液的质量分数保持不变。
(3)一定温度时,向某饱和溶液中加入该溶质,所得溶液的溶质质量分数保持不变。
(4)一定温度时,对某饱和溶液恒温蒸发溶剂,所得溶液的溶质质量分数保持不变。
(5)对于溶解度随温度升高而增大的物质来说,将其饱和溶液(底部没有固体时)升高温度,所得溶液的溶质质量分数保持不变。而对于溶解度随温度升高而减小的物质(熟石灰)来说,降低温度,所得溶液的溶质质量分数保持不变。
1. 概念:溶液中溶质的质量分数是溶质质量与溶液质量之比。
2. 表达式:
溶质质量分数=
 =
=
3. 含义:溶质质量分数的含义是指每100份质量的溶液中含有溶质的质份为多少。如100g10%的NaCl溶液中含有10gNaCl.。不要误认为是100g水中含有10gNaCl。
应用溶质质量分数公式的注意事项:
①溶质的质量是指形成溶液的那部分溶质,没有进入溶液的溶质不在考虑范围之内。如在20℃时,100g水中最多能溶解36gNaCl,则20gNaCl放入50g 水中溶解后,溶质的质量只能是18g。
②溶液的质量是该溶液中溶解的全部溶质的质量与溶剂的质量之和(可以是一种或几种溶质)。
③计算时质量单位应统一。
④由于溶液的组成是指溶液中各成分在质量方面的关系,因此,对溶液组成的变化来说,某物质的质量分数只有在不超过其最大溶解范围时才有意义。
例如在20℃时,NaCl溶液中溶质的质量分数最大为26.5%,此时为该温度下氯化钠的饱和溶液,再向溶液中加入溶质也不会再溶解,浓度也不会再增大。因此离开实际去讨论溶质质量分数更大的NaCl溶液是没有意义的。
⑤运用溶质质量分数表示溶液时,必须分清溶质的质量、溶剂的质量和溶液的质量。
a.结晶水合物溶于水时,其溶质指不含结晶水的化合物。如CuSO4·5H2O溶于水时,溶质是CuSO4。
溶质质量分数=
 ×100%
×100%b.当某些化合物溶于水时与水发生了反应,此时溶液中的溶质是反应后生成的物质。如Na2O溶于水时发生如下反应:Na2O+H2O==2NaOH。反应后的溶质是NaOH,此
溶液的溶质质量分数=
 。
。c.若两种物质能发生反应,有沉淀或气体生成,此时溶液中的溶质质量分数=

影响溶质质量分数的因素:
(1)影响溶质质量分数的因素是溶质、溶剂的质录,与温度、是否饱和无关。在改变温度的过程中若引起溶液中溶质、溶剂质量改变,溶质的质量分数也会改变,但归根结底,变温时必须考虑溶质、溶剂的质量是否改变。因而,影响溶质的质量分数的因素还是溶质、溶剂的质量。例如:
①将饱和的NaNO3溶液降低温度,由于析出品体,溶液中溶质的质缺减少,溶剂的质量不变,所以溶液中溶质的质量分数变小。
②将饱和的NaNO3溶液升高温度,只是溶液变成了不饱和溶液,溶液中溶质、溶剂的质量不变,因而溶液中溶质的质量分数不变。
(2)不要认为饱和溶液变成不饱和溶液,溶质的质量分数就变小;也不要认为不饱和溶液变成饱和溶液,溶质的质量分数就变大;要具体问题具体分析。
有关溶质质量分数计算的类型
(1)利用公式的基本计算
①已知溶质、溶剂的质量,求溶质的质量分数。
直接利用公式:溶质的质量分数=
 ×100%
×100% ②已知溶液、溶质的质量分数,求溶质、溶剂的质量。
利用公式:溶质的质量=溶液的质量×溶质的质量分数
溶剂的质量=溶液的质量一溶质的质量
③已知溶质的质量、溶质的质量分数,求溶液的质量。
利用公式:溶液的质量=溶质的质量÷溶质的质量分数
④质量、体积、密度与溶质质量分数的换算
当溶液的量用体积表示时,计算时应首先将溶液的体积换算成质量后再进行相关计算。因为计算溶质的质量分数的公式中各种量都是以质量来表示的,不能以体积的数据来代替。
利用公式:溶液的质量=溶液的体积×溶液的密度
(2)溶液的稀释与浓缩
| 方法 | 计算依据 | 计算公式 | |
| 溶液的稀释 | ①加水稀释 ②加稀溶液稀释 |
①加水稀释前后,溶液中溶质的质量不变 ②用稀溶液稀释浓溶液时。稀溶液中溶质的质量与浓溶液中溶质的质量之和等于混合后溶液中溶质的质量 |
加水稀释:稀释前后溶液中溶质的质量不变 m浓×ω浓%=(m浓+m水)×ω稀% |
| 溶液的浓缩 | ①添加溶质 ②蒸发溶剂 ③加入浓溶液 | ①原溶液中的溶质与后加入的溶质质量之和等于混合后溶液中的溶质质量 ②蒸发溶剂前后溶液中溶质的质量不变(没有溶质析出) ③原溶液中的溶质与后加入浓溶液中的溶质质量之和等于混合后溶液中的溶质质量 |
蒸发浓缩:浓缩前后溶液中溶质的质量不变(m稀-m水)×ω浓%=m稀×ω稀% |
a.几种溶液混合,溶液的体积不能简单相加,即V总≠VA+VB
b.混合后溶液的质量、溶质的质量可以相加,即m总=mA+mB
c. 要求混合后溶液的总体积,必须依据公式V=m/ρ,所以要知道混合溶液的密度才能求出总体积。
(3)饱和溶液中溶质质量分数的计算
a. 固体溶解度的计算公式
根据固体溶解度的计算公式[溶解度(S)=
 ×100g]可推导出:
×100g]可推导出: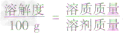 ,
,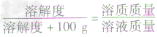
b. 溶解度与溶质质量分数的关系
| 溶解度 | 溶质质量分数 | |
| 意义 | 物质溶解性的量度,受外界温度的影响 | 表示溶液中溶质质量的多少,不受外界条件影响 |
| 容积要求 | 100g | 无要求 |
| 温度要求 | 与温度有关 | 一般与温度无关 |
| 溶液是否饱和 | 一定达到饱和 | 不一定饱和 |
| 计算公式 |  ×100g ×100g |
 |
| 单位 | 克 | 无单位 |
| 联系 | 饱和溶液中溶质的质量分数= | |
特殊的溶质质量分数的计算:
(1)结晶水合物溶于水时,其溶质指不含结晶水的化合物。
如CuSO4·5H2O溶于水时,溶质是CuSO4。
溶质质量分数=
 ×100%
×100%(2)溶质只能是已溶解的那一部分,没有溶解的不能做溶质计算
如20℃时,20gNaCl投入到50g中水中(20℃时,NaCl的溶解度为36g)。20℃时50g水最多只能溶解18gNaCl,如溶质的质量为18g,而不是20g,所以该NaCl溶液的质量分数=18g/(50g+18g)×100%=26.5%。
(3)当某些化合物溶于水时与水发生了反应,此时溶液中的溶质是反应后生成的物质。如Na2O溶于水时发生如下反应:Na2O+H2O==2NaOH。反应后的溶质是NaOH,此
溶液的溶质质量分数=
 。
。(4)某混合物溶于水,要计算某一溶质的质量分数,溶液的质量包括混合物与水的质量
如5gNaCl和1gKNO3的混合物溶于100g水,计算NaCl的溶质质量分数:
ω(NaCl)=5g/(5g+1g+100g)×100%=4.7%。
(5)利用元素的质量分数进行计算
溶液中溶质的质量分数与溶质中某元素的质量分数之间有着联系。溶液的溶质质量分数×溶质中某元素的质量分数=溶液中某元素的质量分数。
溶质质量分数的不变规律:
(1)从一瓶溶液中不论取出多少溶液,取出溶液及剩余溶液的溶质质量分数与原来溶液中溶质质量分数相同。
(2)溶质、溶质质量分数均相同的两种溶液混合,所得溶液的质量分数保持不变。
(3)一定温度时,向某饱和溶液中加入该溶质,所得溶液的溶质质量分数保持不变。
(4)一定温度时,对某饱和溶液恒温蒸发溶剂,所得溶液的溶质质量分数保持不变。
(5)对于溶解度随温度升高而增大的物质来说,将其饱和溶液(底部没有固体时)升高温度,所得溶液的溶质质量分数保持不变。而对于溶解度随温度升高而减小的物质(熟石灰)来说,降低温度,所得溶液的溶质质量分数保持不变。
发现相似题
与“实验室配制100g 10%的氯化钠溶液时,(1)需要 ______g氯化钠...”考查相似的试题有:
- 化学仪器是我们进行实验的必要用品,那么请根据语句中提供的信息,写出仪器的名称(1)能直接加热且常用来作反应容器的玻璃仪...
- 规范的实验操作是实验成功的前提,请回答:(1)取用8.0mL的稀硫酸,应选用__________mL的量筒。(2)胶头滴管用过后应______...
- 下列有关实验操作的叙述,不正确的是( )A.给试管中液体加热时,液体体积不超过试管容积的1/3B.把烧杯置于铁架台的铁圈上直...
- 下列实验操作正确的是( )A.将称量物放在托盘天平的右盘上称量B.用酒精灯的外焰给试管加热C.将粗盐加入到盛有10毫升水的...
- 量取液体时用的仪器是 ,读数时视线要与 相平
- 我国约在南北朝时就开始冶炼黄铜。黄铜是铜和锌的合金。为了测定某黄铜中铜的质量分数,称取10.0g黄铜样品置于烧杯中,慢慢加...
- 为了测定黄铜(铜、锌合金)的组成,某研究性学习小组称取该样品10g,向其中逐滴加入9.8%的稀硫酸至刚好不再产生气体为止.反...
- 某化学研究小组对当地的石灰石样品进行了研究.称取石灰石样品8g,把40g稀盐酸分四次加入样品中,测得实验数据见下表(假设石...
- 有100克5%的氯化钠溶液,若将其溶质的质量分数增大一倍,可采用的方法是( )A.把溶剂蒸发掉一半B.加入5g氯化钠固体C.把溶...
- 水在实验室和日常生活中有着十分重要的作用。(1)在实验室里,水除了可以用来刷洗仪器,还可以______________(写出一种用途...