本试题 “铜单质及其化合物在很多领域有重要用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。(1)Cu位于元素周期表第ⅠB族。Cu2+的核外电子排布式为_______...” 主要考查您对化学键与化学反应中能量变化的关系
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 化学键与化学反应中能量变化的关系
化学键与化学反应中能量变化的关系:
断开化学键要吸收能量,形成化学键要释放能量,通过化学键的键能可以计算断开化学键或形成化学键所需的能量。
反应热与键能的关系:
化学反应的热效应来源于化学反应过程中断裂旧化学键并形成新化学键时的能量变化。当破坏旧化学键所吸收的能量小于形成新化学键所释放的能量时,为放热反应;
当破坏旧化学键所吸收的能量大于形成新化学键所释放的能量时,为吸热反应。
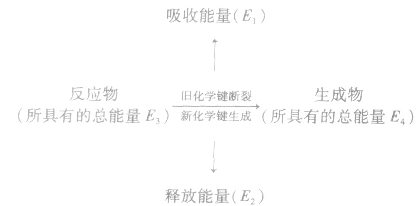
若 反应为放热反应;若
反应为放热反应;若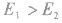 或
或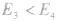 ,反应为吸热反应。
,反应为吸热反应。
断开化学键要吸收能量,形成化学键要释放能量,通过化学键的键能可以计算断开化学键或形成化学键所需的能量。
反应热与键能的关系:
化学反应的热效应来源于化学反应过程中断裂旧化学键并形成新化学键时的能量变化。当破坏旧化学键所吸收的能量小于形成新化学键所释放的能量时,为放热反应;
当破坏旧化学键所吸收的能量大于形成新化学键所释放的能量时,为吸热反应。

若
 反应为放热反应;若
反应为放热反应;若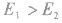 或
或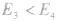 ,反应为吸热反应。
,反应为吸热反应。 发现相似题
与“铜单质及其化合物在很多领域有重要用途,如金属铜用来制造电...”考查相似的试题有:
- 下列各组晶体物质中,化学键类型相同,晶体类型也相同的是 ( )。①SiO2和SO3 ②晶体硼和HCl ③CO2和SO2 ④晶体硅和金刚石 ⑤晶...
- 共价键、离子键和分子间作用力是微粒之间的三种作用力。下列晶体 ①Ba(OH)2②SiO2 ③金刚石 ④KCl ⑤干冰中,含有两种作用力的是A...
- 拆开1 mol化学键所吸收的能量是该化学键的键能,它的大小可以衡量化学键的强弱。化学键Si—OSi—ClH—HH—ClSi—SiSi—C键能/kJ·mol...
- 下列关于化学键的说法中,正确的是( )A.离子化合物中一定只含有离子键B.含有共价键的一定是共价化合物C.任何物质中都含...
- 下列说法正确的是:A.有机物CH2=CH-CH3中其碳原子杂化类型有sp3和sp2,其中有两个π键,7个σ键B.分子CO和N2的原子总数相同,...
- 下列哪一组元素的原子间反应可以形成离子键原子abcdefgM层电子数1234567A.a和cB.a和fC.d和gD.b和g2答案BD3考点梳理化学键...
- 下列各组物质中化学键的类型相同的是A.HCl MgCl2NH4ClB.H2O Na2O CO2C.CaCl2NaOH H2OD.NH3H2O CO2
- 下列说法中正确的是[ ]A.物质发生化学反应都伴随着能量变化。B.伴有能量变化的物质变化都是化学变化。C.在一个确定的化学...
- 肼(N2H4)是一种可用于火箭或原电池的燃料。已知:N2(g)+2O2(g)=2NO2(g) △H=+67.7 kJ/mol ①N2H4(g)+O2(g)=N2(g...
- 能说明苯分子中碳碳键不是单、双键相间交替的事实是①苯不能使酸性KMnO4溶液褪色 ②苯环中碳碳键均相同 ③邻二甲苯只有一种 ④苯...