本试题 “下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中间有一个可以上下滑动的隔板(其质量忽略不计).其中能表示等质量的氢气与氦气的是( ...” 主要考查您对摩尔质量
阿伏加德罗定律
物质的量的有关计算
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 摩尔质量
- 阿伏加德罗定律
- 物质的量的有关计算
摩尔质量:
定义:单位物质的量的物质所具有的质量
符号:M
单位:g/mol(g·mol-1)
计算公式:摩尔质量(M)=质量(m)/物质的量(n)
摩尔质量、相对分子质量、1mol物质的质量三者的区别和联系:
1mol物质的质量在数值上和摩尔质量相同,二者的区别在于单位不一样,质量的单位是千克(kg),而摩尔质量的单位是g/mol。相对分子质量与摩尔质量单位不同,但在数值上二者相等。
平均摩尔质量的计算方法:
- 已知混合物质的总质量m(混)和总物质的量n(混):M =m(混)/n(混)
- 已知同温同压下混合气体的密度ρ(混)是一种简单气体A的密度ρ(A)的倍数d(也叫相对密度)d= ρ(混)/ ρ(A),则M混= ρ混M混/ ρ(A)
- 在溶液中,M=1000ρw%/c(ρ指溶液的密度,w%指溶液中溶质的质量分数,c表示溶液的浓度)
- 已知某状况下的混合气体的密度M=ρVm(ρ表示气体的密度,Vm表示在该状况下的气体的摩尔体积)
- 已知混合物各成分的摩尔质量和其在混合体系内的物质的量分数或体积分数M=M1×n1%+M2×n2% =M1×V1%+M2×V2%
阿伏伽德罗定律:
同温同压下,相同体积的任何气体含有相同的分子数。
阿伏伽德罗定律的使用范围:
阿伏伽德罗定律只对气体起作用,使用于任何气体,包括混合气体。
方法与技巧:
- “三同”定“一同”(温度、压强、气体体积、气体分子数);“两同”定“比例”。
- 阿伏伽德罗定律及其推论的数学表达式可由理想气体状态方程(PV=nRT)或其变形形式(PM=ρRT)推出,不用死记硬背。
理想气体状态方程:
理想气体状态方程的表达式:PV= nRT
P表示压强,V 表示体积,T表示温度,R是常数,n是气体的物质的量。
可根据此方程来推断阿伏伽德罗定律的相关推论:
| 条件 | 结论 | 语言表达 |
| T、P相同 | n1/n2=V1/V2 | 同温同压下,气体的分子数与其体积成正比 |
| T、V相同 | n1/n2=P1/P2 | 同温同体积,压强与其分子数成正比 |
| n、P相同 | V1/V2=T1/T2 | 分子数、压强相同的气体,体积与温度成正比 |
| n、T相同 | P1/P2= V2/V1 | 分子数、温度相同的气体,压强与体积成反比 |
| T、P相同 | ρ1/ρ2=M1/M2 | 同温同压下,气体的密度与相对分子质量(摩尔质量)成正比 |
| T、P、V相同 | m1/m2=M1/M2 | 同温同压下,相同体积的气体,质量与其相对分子质量成正比 |
| T、P、m相同 | M1/M2=V2/V1 | 同温同压下,等质量的气体,相对分子质量与其体积成反比 |
计算物质的量浓度时应注意的问题:
物质的量浓度是表示溶液组成的一个重要物理量,是高中化学的重要内容之一。应用时要注意以下几方面的问题:
1.注意溶质是什么
对有些特殊情况要注意辨别,不能出错。如SO2、CuSO4·5H2O等溶于水后所得溶液中的溶质分别为 H2SO4和CuSO4,进行有关氨水的浓度计算时以NH3 为溶质来计算等。
2.注意溶液的体积
主要注意两点:一是不能用水的体积代替溶液的体积;二是当题设未给溶液密度时,可将各溶液(一般为稀溶液)的体积相加(如溶液混合、稀释),认为其和为溶液的总体积;当给出密度时,则需通过密度求溶液的最终体积。
3.注意单位运算
在概念理解及应用中,要注意各物理量的单位.一是各物理量的单位要相互匹配,二是从单位运算人手.能简化解题思路,快速求解。
4.注意溶解度的影响
第一,物质的量浓度适用于表示不饱和及饱和溶液中溶质与溶剂的关系,不适用于过饱和溶液(溶质未溶解完全);
第二,注意一些典型问题,如Ca(OH)2的溶解度随温度变化情况及气体物质在溶剂中的溶解问题等。
5.注意密度变化规律
在溶液混合和溶液稀释等问题中,在注意溶液体积变化的同时,还要考虑溶液密度的变化对溶质物质的量浓度的影响。如强酸、强碱、盐等溶液的密度随浓度增大而增大;氨水、乙醇等溶液的密度随浓度增大而减小。
6.注意实验情景
在计算溶液配制或溶液稀释等问题中物质的量浓度时,一要注意不能把水的体积当作溶液的体积;二是配制溶液时,要注意容量瓶规格与所需溶液体积的关系。因容量瓶的规格是固定的,所以选用的容量瓶的规格要等于或略大于所需溶液的体积。
7.注意物质与其组成粒子的关系
物质与其组成粒子的物质的量、物质的量浓度之间的关系可以通过电离方程式进行分析。如Na2SO4 溶液中c(Na+)=2c(SO42-)=2c(Na2SO4)。
以物质的量为核心的演绎公式:
1.溶液稀释定律
(1)对于已知质量分数溶液的稀释:稀释前后溶质的质量不变,即: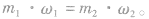
(2)对于已知物质的量浓度溶液的稀释:稀释前后溶质的物质的量不变,即: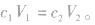
2.物质的量浓度与溶质质量分数的换算
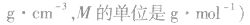
3.溶解度S与溶质质量分数ω的换算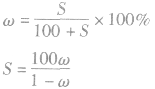
4.溶解度与饱和溶液物质的量浓度的换算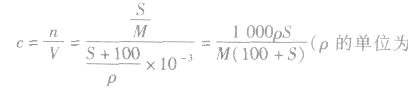

5.标准状况下气体溶于水后所得溶液的物质的量浓度的计算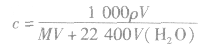
式中V为标准状况下气体的体积(L),V(H2O)为水的体积(L),ρ为溶液的密度(g·cm-3)。
6.相对密度(D)的计算及意义两种气体在同温同压下的密度之比即为相对密度,显然,它等于相对分子质量(或摩尔质量)之比,即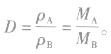
与“下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容...”考查相似的试题有:
- 下列叙述正确的是( )A.1molSO42-的质量是96gB.1molH2O的质量是18g/molC.CO2的摩尔质量是44gD.HCl的相对分子质量是36.5g...
- 阿伏加德罗曾做过这样一个实验:“一抽空的密闭容器重M g,在标准状况下,盛满以相同物质的量混合的NO和H2的混合气体后,称量...
- 在含有NaI、Na2SO3和FeBr2各1 mol的溶液中通入足量的Cl2,将溶液在空气中加热蒸干并充分灼烧,最终得到剩余的固体物质是 ( ...
- (8分)从四大基本反应类型看, 反应都属于氧化还原反应, 反应和 反应部分属于氧化还原反应, 反应全部都属于非氧化还原反应。
- 在下列反应中,属于氧化还原反应的是A.2H2O22H2O + O2B.CaCO3CaO + CO2C.CaO +H2O = Ca(OH)2D.CaCO3+ 2HCl = CaCl2+CO2↑+H2O
- 相同状况下,下列气体所占体积最大的是( )A.3gH2B.16gO2C.32gH2SD.64gSO2
- 设NA为阿佛加德罗常数,下列说法中正确的是A.0.1mol钠和O2在一定条件下反应生成Na2O和Na2O2混合物时,失去电子数为0.1NAB.0...
- 标准状况下的H2和CO的混合气体总体积4.48L,其总质量为4.3g.求:(1)混合气体的平均摩尔质量______ g/mol;(2)混合气体...
- 由葡萄糖(C6H12O6)、乙酸(CH3COOH)和尿素[CO(NH2)2]组成的混合物240g,在一定条件下完全燃烧,生成H2O的质量是( )A....
- 0.6molO2和0.4molO3的质量______(填“相等”或“不相等”,下同),他们所含的分子数______,所含的原子数______.