本试题 “(8分) 已知某反应A(g)+B(g)?C(g)+D(g)进行过程中的能量变化如图所示,请回答下列问题:(1)该反应的ΔH=________kJ·mol-1(用含E1、E2的代数式表示)。(1...” 主要考查您对焓变、反应热
中和热
燃烧热
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 焓变、反应热
- 中和热
- 燃烧热
反应热,焓变:
化学能可以转化为热能、电能和光能等,化学反应中的能量变化,通常主要表现为热量的变化。
1.定义:在化学反应过程中,当生成物和反应物具有相同温度时所放出或吸收的热量,通常叫做化学反应的反应热。在恒温、恒压条件下,化学反应过程中吸收或放出的热量称为反应的焓变。
2.符号:△Ⅳ
3.单位:kJ·mol-1
4.产生原因:化学反应过程中旧键断裂吸收的总能量与新键形成释放的总能量不相等,故化学反应均伴随着能量变化——吸热或放热。
5.表示方法:放热反应的△H<0,吸热反应的△H>0.
化学能可以转化为热能、电能和光能等,化学反应中的能量变化,通常主要表现为热量的变化。
1.定义:在化学反应过程中,当生成物和反应物具有相同温度时所放出或吸收的热量,通常叫做化学反应的反应热。在恒温、恒压条件下,化学反应过程中吸收或放出的热量称为反应的焓变。
2.符号:△Ⅳ
3.单位:kJ·mol-1
4.产生原因:化学反应过程中旧键断裂吸收的总能量与新键形成释放的总能量不相等,故化学反应均伴随着能量变化——吸热或放热。
5.表示方法:放热反应的△H<0,吸热反应的△H>0.
中和热:
在稀溶液中,酸和碱发生中和反应生成1molH2O时的反应热。中和热的表示方法: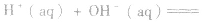
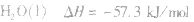
在稀溶液中,酸和碱发生中和反应生成1molH2O时的反应热。中和热的表示方法:
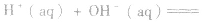
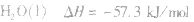
影响中和热测定的因素:
中和反应巾放出的热量为(m1+m1)·c·(t1-t2),其巾溶液的比热容c是已知的,对于给定的反应物的质量m1和m2也是定值,这样求算出的中和热是否接近 57.3kl·mol-1,取决于溶液温度的变化。
在整个实验过程中应把好两关:①隔热关。如:小烧杯周围的泡沫塑料要填满;盖板上两孔只要正好使温度计和环形玻璃搅拌棒通过即可;倒人NaOH溶液要迅速等,尽可能减少实验过程中热量的散失。②准确关。如:配制溶液的浓度要准;NaOH溶液要新制,因为久置的NaOH溶液可能变质导致浓度不准;量取液体体积时读数要准;对溶液温度要读到最高点。
注意事项:
(1)这里的溶液一般要求是稀溶液,这是因为浓酸溶液和浓碱溶液相互稀释时会放出热量
(2)强酸与强碱的反应实质是H+和OH-反应(即与酸、碱的种类无关),通过多次实验测定,1molH+和1molOH-反应生成lmol H2O(l)时,放出的热量为 57.3kJ
(3)中和热是以生成1molH2O为基准的,因此表示中和热的热化学方程式中,水的化学计量数为1,酸、碱的化学计量数可以为分数
燃烧热:
在101kPa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热。单位为kJ/mol
注意事项:
(1)规定是在101kPa 下测出的热量。书中提供的燃烧热数据都是在25℃、101kPa下测定出来的
(2)规定可燃物的物质的量为1mol(这样才有可比性)。因此,表示可燃物的燃烧热的热化学方程式中,可燃物的化学计量数为1,其他物质的化学计量数常出现分数
(3)规定生成稳定的氧化物,例如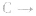
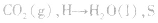
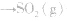 等
等
(4)叙述燃烧热时、不用“+”“-”,在热化学方程式中用△H表示时取“-”
在101kPa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热。单位为kJ/mol
燃烧热和中和热的异同:
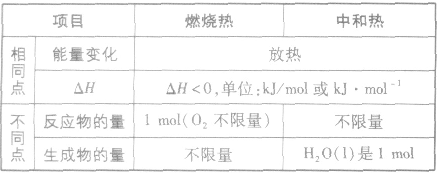
注意事项:
(1)规定是在101kPa 下测出的热量。书中提供的燃烧热数据都是在25℃、101kPa下测定出来的
(2)规定可燃物的物质的量为1mol(这样才有可比性)。因此,表示可燃物的燃烧热的热化学方程式中,可燃物的化学计量数为1,其他物质的化学计量数常出现分数
(3)规定生成稳定的氧化物,例如
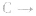
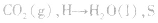
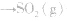 等
等 (4)叙述燃烧热时、不用“+”“-”,在热化学方程式中用△H表示时取“-”
发现相似题
与“(8分) 已知某反应A(g)+B(g)?C(g)+D(g)进行过程中的能量变...”考查相似的试题有:
- 已知:在热力学标准态(298K、1.01×105 Pa)下,由稳定的单质发生反应生成1mol化合物的反应热叫该化合物的生成热(△H)。下图为氧...
- 已知H—H键能436 kJ/mol;Cl—Cl键能243kJ/mol;H—Cl键能431 kJ/mol,则下列热化学方程式正确的是A.H2(g)+Cl2(g)="2HCl(g)" Δ...
- 已知: 2H2(g)+O2(g)=2H2O(l) △H=" a" kJ/mol, 2H2(g)+O2(g)=2H2O(g) △H=" b" kJ/mol, 则a、b的大小关系是( )A.a=bB.a...
- 我国发射“神五”所用的长征2号火箭的主要燃料是偏二甲肼(C2H8N2),氧化剂是NO2,燃烧产物只有N2、CO2和H2O。有的国家用肼(N...
- 已知可逆反应2SO2+ O2 2SO3,当生成2 mol SO3时放出热量为Q,现将1 mol SO2和0.5 mol O2在相同条件下反应生成SO3放出的热量为...
- 某些化学键键能数据如下:化学键H—HCl—ClH—Cl键能/ kJ·mol-1436243431 则下列热化学方程式不正确的是 ( )A.H2(g)+Cl2(g)=HC...
- 在25 ℃、101 kPa下,1 g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68 kJ。下列热化学方程式正确的是A.CH3OH(l)+3/2O2(g)===C...
- 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的一种反应原理如下:CH3OH(g) + H2O(g) → CO2(g) + 3H2(g) – 49.0 kJ下列说法...
- 氮是地球上含量丰富的—种元素,氮及其化合物在工农业生产、生活中有着重要作用,减少N 的氧化物在大气中的排放是环境保护的重...
- (15分)甲醇是一种可再生能源,具有广泛的开发和应用前景.请回答下列与甲醇有关的问题.(1)甲醇分子是____________分子(填“极...