本试题 “已知石墨和金刚石燃烧的热化学方程式分别为:C(石墨·s)+O2(g)===CO2(g);△H== -393.5kJ·mol-1C(金刚石·s)+O2(g)===CO2(g);△H== -395.4kJ·mol-1关于金刚...” 主要考查您对化学反应进行的方向
盖斯定律
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 化学反应进行的方向
- 盖斯定律
化学反应的方向与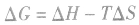 :
:
1.化学反应进行方向的判据
(1)由稳定性弱的物质向稳定性强的物质转变
如 ,稳定性
,稳定性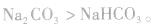
(2)离子反应总是向着使反应体系中某些离子浓度减小的方向进行
①溶解度大的物质向溶解度小的物质转变,如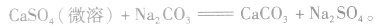
②由相对强酸(碱)向相对弱酸(碱)转变,如 ,
,  所以酸性强弱:
所以酸性强弱: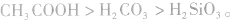
(3)由难挥发性物质向易挥发性物质转变
如 所以沸点:
所以沸点: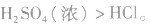
(4)由氧化性(还原性)强的物质向氧化性(还原性)弱的物质转变
如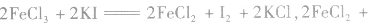
 ,则氧化性:
,则氧化性: 。
。
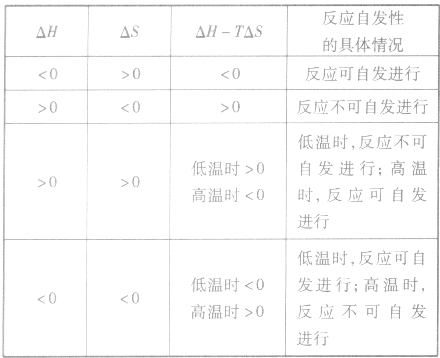
2.焓变和熵变共同判断反应的方向:
在温度、压强一定的条件下,自发反应总是向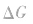
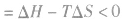 的方向进行,直至达到平衡状态;
的方向进行,直至达到平衡状态;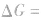
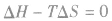 表明反应已达到平衡状态;
表明反应已达到平衡状态;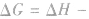
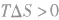 表明反应不能自发进行。
表明反应不能自发进行。
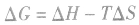 :
:1.化学反应进行方向的判据
(1)由稳定性弱的物质向稳定性强的物质转变
如
 ,稳定性
,稳定性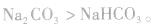
(2)离子反应总是向着使反应体系中某些离子浓度减小的方向进行
①溶解度大的物质向溶解度小的物质转变,如
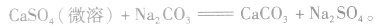
②由相对强酸(碱)向相对弱酸(碱)转变,如
 ,
,  所以酸性强弱:
所以酸性强弱: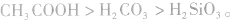
(3)由难挥发性物质向易挥发性物质转变
如
 所以沸点:
所以沸点: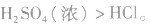
(4)由氧化性(还原性)强的物质向氧化性(还原性)弱的物质转变
如
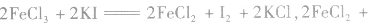
 ,则氧化性:
,则氧化性: 。
。 2.焓变和熵变共同判断反应的方向:
在温度、压强一定的条件下,自发反应总是向
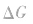
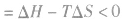 的方向进行,直至达到平衡状态;
的方向进行,直至达到平衡状态;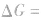
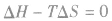 表明反应已达到平衡状态;
表明反应已达到平衡状态;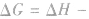
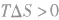 表明反应不能自发进行。
表明反应不能自发进行。
盖斯定律的内容:
不管化学反应是一步完成还是分几步完成,其反应热是相同的。换句话说,化学反应的反应热只与反应的始态和终态有关,而与反应进行的途径无关。如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一一步完成时的反应热是相同的,这就是盖斯定律。
盖斯定律的意义:
利用盖斯定律可以间接计算某些不能直接测得的反应的反应热。例如: 的△H无法直接测得,可以结合下面两个反应的△H,利用盖斯定律进行计算。
的△H无法直接测得,可以结合下面两个反应的△H,利用盖斯定律进行计算。

根据盖斯定律,就可以计算出所给反应的△H。分析上述两个反应的关系,即知


盖斯定律在反应热大小比较中的应用:
1.同一反应生成物状态不同时

若按以下思路分析:

2.同一反应物状态不同时

3.两个有联系的不同反应相比

并且据此可写出下面的热化学方程式:


不管化学反应是一步完成还是分几步完成,其反应热是相同的。换句话说,化学反应的反应热只与反应的始态和终态有关,而与反应进行的途径无关。如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一一步完成时的反应热是相同的,这就是盖斯定律。
盖斯定律的意义:
利用盖斯定律可以间接计算某些不能直接测得的反应的反应热。例如:
 的△H无法直接测得,可以结合下面两个反应的△H,利用盖斯定律进行计算。
的△H无法直接测得,可以结合下面两个反应的△H,利用盖斯定律进行计算。
根据盖斯定律,就可以计算出所给反应的△H。分析上述两个反应的关系,即知


盖斯定律在反应热大小比较中的应用:
1.同一反应生成物状态不同时

若按以下思路分析:

2.同一反应物状态不同时

3.两个有联系的不同反应相比

并且据此可写出下面的热化学方程式:


发现相似题
与“已知石墨和金刚石燃烧的热化学方程式分别为:C(石墨·s)+O2(...”考查相似的试题有:
- 石墨、金刚石燃烧的热化学方程式分别为:C(石墨,s)+O2(g)CO2(g) ΔH="-393.51" kJ·mol-1C(金刚石,s)+O2(g)CO2(g) ΔH="-395.41...
- 下列说法中,正确的是[ ]A.Kw随温度、浓度的改变而改变B.凡是能自发进行的化学反应,一定是△H0C.对已达到化学平衡的反应,...
- 下列关于化学反应的自发性叙述中正确的是[ ]A.焓变小于0而熵变大于0的反应肯定是自发的B.焓变和熵变都小于0的反应肯定是自...
- 对可逆反应2SO2+O2≒2SO3,在混合气体中充入一定量的18O2,足够长的时间后,18O原子()A.只存在于O2中B.只存在于O2和SO3中C...
- 用于净化汽车尾气的反应:2NO(g)+2CO(g)2CO2(g)+N2(g),已知该反应速率极慢,570 K时平衡常数为1×1059。下列说法正确的是A...
- 通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能.键能的大小可用于估算化学反应的反应热(△H).化学键Cl-ClH-H...
- (1)已知可逆反应:M(g)+N(g)⇌P(g)+Q(g);△H>0,请回答下列问题.①若要增大M的转化率,在其它条件不变的情况下可以...
- 研究碳、氮、硫的氧化物的性质对化工生产和环境保护有重要意义.(1)下列措施中,有利于降低大气中的CO2、SO2、NO2浓度的有_...
- 下列说法正确的是[ ]A.硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物B.蔗糖、硫酸钡、水分别属于非电解质、弱电解...
- 甲醇是重要的化工原料,在日常生活中有着广泛的应用。(1)工业上一般采用下列两种反应合成甲醇:反应I:CO(g)+2H2(g)CH3OH(g) ...