本试题 “重晶石(BaSO4)与碳在高温下焙烧可制得BaS。①BaSO4(s) + 4C(s)4CO(g)+BaS(s) △H=+571.2 kJ·mol-1②BaSO4(s)+2C(s)2CO2(g)+BaS(s) △H=+226. 2 kJ·mol-1下列说法...” 主要考查您对吸热反应、放热反应
焓变、反应热
燃烧热
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 吸热反应、放热反应
- 焓变、反应热
- 燃烧热
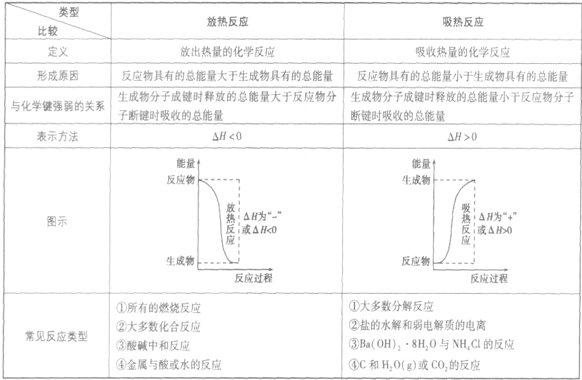
吸热反应:
吸收热量的反应,即生成物的总能量大于反应物的总能量,反应需要吸收能量
放热反应:
放出热量的反应,即生成物的总能量小于反应物的总能量,反应释放出能量
放热反应和吸热反应的比较:
吸收热量的反应,即生成物的总能量大于反应物的总能量,反应需要吸收能量
放热反应:
放出热量的反应,即生成物的总能量小于反应物的总能量,反应释放出能量
放热反应和吸热反应的比较:

反应热,焓变:
化学能可以转化为热能、电能和光能等,化学反应中的能量变化,通常主要表现为热量的变化。
1.定义:在化学反应过程中,当生成物和反应物具有相同温度时所放出或吸收的热量,通常叫做化学反应的反应热。在恒温、恒压条件下,化学反应过程中吸收或放出的热量称为反应的焓变。
2.符号:△Ⅳ
3.单位:kJ·mol-1
4.产生原因:化学反应过程中旧键断裂吸收的总能量与新键形成释放的总能量不相等,故化学反应均伴随着能量变化——吸热或放热。
5.表示方法:放热反应的△H<0,吸热反应的△H>0.
化学能可以转化为热能、电能和光能等,化学反应中的能量变化,通常主要表现为热量的变化。
1.定义:在化学反应过程中,当生成物和反应物具有相同温度时所放出或吸收的热量,通常叫做化学反应的反应热。在恒温、恒压条件下,化学反应过程中吸收或放出的热量称为反应的焓变。
2.符号:△Ⅳ
3.单位:kJ·mol-1
4.产生原因:化学反应过程中旧键断裂吸收的总能量与新键形成释放的总能量不相等,故化学反应均伴随着能量变化——吸热或放热。
5.表示方法:放热反应的△H<0,吸热反应的△H>0.
燃烧热:
在101kPa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热。单位为kJ/mol
注意事项:
(1)规定是在101kPa 下测出的热量。书中提供的燃烧热数据都是在25℃、101kPa下测定出来的
(2)规定可燃物的物质的量为1mol(这样才有可比性)。因此,表示可燃物的燃烧热的热化学方程式中,可燃物的化学计量数为1,其他物质的化学计量数常出现分数
(3)规定生成稳定的氧化物,例如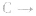
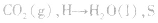
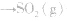 等
等
(4)叙述燃烧热时、不用“+”“-”,在热化学方程式中用△H表示时取“-”
在101kPa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热。单位为kJ/mol
燃烧热和中和热的异同:
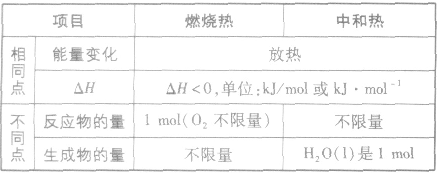
注意事项:
(1)规定是在101kPa 下测出的热量。书中提供的燃烧热数据都是在25℃、101kPa下测定出来的
(2)规定可燃物的物质的量为1mol(这样才有可比性)。因此,表示可燃物的燃烧热的热化学方程式中,可燃物的化学计量数为1,其他物质的化学计量数常出现分数
(3)规定生成稳定的氧化物,例如
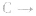
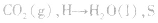
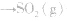 等
等 (4)叙述燃烧热时、不用“+”“-”,在热化学方程式中用△H表示时取“-”
发现相似题
与“重晶石(BaSO4)与碳在高温下焙烧可制得BaS。①BaSO4(s) + 4C(s)...”考查相似的试题有:
- 下列说法中,不正确的是[ ]A.化学反应必然伴随能量变化B.25℃,101kPa下,l mol C8H18(辛烷)燃烧生成CO2和液态水时放出551...
- 下列关于能量的说法错误的是( )A.化学反应必然伴随发生能量变化B.化学变化中的能量变化主要是由化学键变化引起的C.反应...
- 下列变化过程放热的是[ ]A.H2O(l)===H2O(g) ΔH=+44.0kJ/molB.2HI(g)===H2(g)+I2(g) ΔH=+14.9 kJ/molC.形成化学键时...
- 下列反应前后物质的总能量变化可用如图表示的是( )A.生石灰和水的反应B.碳和二氧化碳反应C.盐酸与氢氧化钠溶液的反应D....
- 反应A(g)+B(g)⇌c(g)+D(g)过程中的能量变化如图所示,回答下列问题.(1)图中a、b分别表示:a:______;b:______....
- 能源危机当前是一个全球性问题,开源节流是应对能源危机的重要举措。(1)下列做法有助于能源“开源节流”的是 (填字母)。a. 大力...
- 下列各组物质的燃烧热相等的是( )A.碳和一氧化碳B.1moL碳和2moL碳C.1moL乙炔和2moL碳D.淀粉和纤维素
- (1)在25℃、101kPa下,16g甲烷燃烧生成CO2和液态水时放热889.6kJ。则表示甲烷燃烧的热化学方程式为________________________...
- 到目前为止,由化学能转变为热能或电能仍然是人类使用最主要的能源。(1)化学反应中放出的热能(焓变,ΔH)与反应物和生成物...
- 工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO,已知CH4、H2和CO的燃烧热(ΔH)分别为-890.3 kJ·mol-1、-285.8 kJ·mo...