本试题 “不管化学过程是一步完成或分为数步完成,这个过程的热效应是相同的已知H2O(g)=H2O(l); △H1=Q1kJ/molC2H5OH(g)=C2H5OH(l); △H2=Q2kJ/molC2H5OH(g)+3O2(...” 主要考查您对化学反应热的计算
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 化学反应热的计算
应用盖斯定律进行计算的方法:
用盖斯定律结合已知反应的反应热求解一些相关反应的反应热时,其关键是设计出合理的反应过程,将已知热化学方程式进行适当数学运算得未知反应的方程式及反应热,使用盖斯定律时应注意以下问题:
(1)当反应方程式乘以或除以某数时,△H也应乘以或除以某数。
(2)反应方程式进行加减运算时,△H也同样要进行加减运算,且要带“+”“-”符号,即把△H看做一个整体进行运算
(3)通过盖斯定律计算并比较反应热的大小时,同样要把△H看做一个整体
(4)在设计的反应过程中常会遇到同一物质固、液、气三态的相互互转化,状态由固→液→气变化时。会吸热;反之会放热
(5)当设计的反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。
反应焓变(反应热)的简单计算:
1.根据热化学方程式计算焓变与参加反应的各物质的物质的量成正比。
2.根据反应物和生成物的能量计算
△H生成物的能量总和一反应物的能量总和。
3.根据反应物和生成物的键能计算
△H反应物的总键能-生成物的总踺能。
4.根据盖斯定律计算
将两个或两个以上的热化学方程式进行适当的数学运算,以求得所求反应的反应热。
5.根据比热公式进行计算
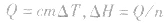
6.反应焓变的大小比较在比较两个热化学方程式中,△H的大小时要带 “+”“-”,比较反应放出或吸收的热量多少时要去掉 “+”“-” .
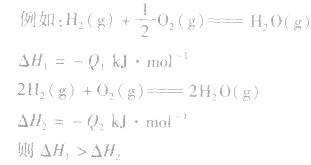
1molH2完全燃烧生成气态水时放出的热量Q1小于2molH完全燃烧生成气态水时放出的热量Q2,即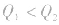 .
.
用盖斯定律结合已知反应的反应热求解一些相关反应的反应热时,其关键是设计出合理的反应过程,将已知热化学方程式进行适当数学运算得未知反应的方程式及反应热,使用盖斯定律时应注意以下问题:
(1)当反应方程式乘以或除以某数时,△H也应乘以或除以某数。
(2)反应方程式进行加减运算时,△H也同样要进行加减运算,且要带“+”“-”符号,即把△H看做一个整体进行运算
(3)通过盖斯定律计算并比较反应热的大小时,同样要把△H看做一个整体
(4)在设计的反应过程中常会遇到同一物质固、液、气三态的相互互转化,状态由固→液→气变化时。会吸热;反之会放热
(5)当设计的反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。
反应焓变(反应热)的简单计算:
1.根据热化学方程式计算焓变与参加反应的各物质的物质的量成正比。
2.根据反应物和生成物的能量计算
△H生成物的能量总和一反应物的能量总和。
3.根据反应物和生成物的键能计算
△H反应物的总键能-生成物的总踺能。
4.根据盖斯定律计算
将两个或两个以上的热化学方程式进行适当的数学运算,以求得所求反应的反应热。
5.根据比热公式进行计算
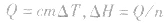
6.反应焓变的大小比较在比较两个热化学方程式中,△H的大小时要带 “+”“-”,比较反应放出或吸收的热量多少时要去掉 “+”“-” .
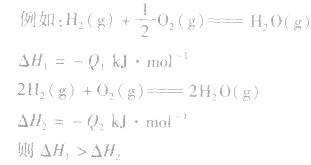
1molH2完全燃烧生成气态水时放出的热量Q1小于2molH完全燃烧生成气态水时放出的热量Q2,即
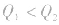 .
. 发现相似题
与“不管化学过程是一步完成或分为数步完成,这个过程的热效应是...”考查相似的试题有:
- 在同温同压下,下列各组热化学方程式中,Q2>Q1的是( )A.2H2(气)+O2(气)=2H2O(气)+Q12H2(气)+O2(气)=2H2O(液)...
- 氢气是一种理想的新能源,如果已知下列两个热化学方程式:2CO(g)+O2(g)═2CO2(g)△H=-563.6kJ•mol-12H2(g)+O2(g)═2H2...
- 在密闭容器中充入0.5mol N2和1.5mol H2发生反应:N2(g)+3H2(g)⇌2NH3(g)△H=-92.4kJ•mol-1,充分反应后放出的热量为( )...
- 25℃时,几种弱酸溶液的pH如下表所示:弱酸CH3COOHH2SO3HCN物质的量浓度mol/L0.010.010.01pH3.42.35.6(1)25℃时,Na2SO3溶液...
- 葡萄糖是人体所需能量的重要来源之一。葡萄糖燃烧的热化学方程式为:C6H12O6(s)+6O2(g)=6CO2(g) +6H2O(l) △H= - 2800kJ/mol。...
- 信息、材料、能源被称为新科技革命的“三大支柱”。特别是能源与环境已经成为当今社会的焦点问题。⑴、中国在世界环境中展示的主...
- (1)用碳棒作电极,电解下列水溶液:①Na2SO4溶液 ②AgNO3溶液 ③KCl溶液 ④CuCl2溶液。通过相同电量时,阴极产生的气体物质的量...
- 在1×105Pa和298K时,将1mol气态AB分子分离成气态A原子和B原子所需要的能量成为键能(kJ•mol-1).下面是一些共价键的键能:(...
- 已知下列两个热化学方程式:H2(g)+1/2O2(g)====H2O(l)△H=-285kJ·mol-1C3H8(g)+5O2(g)====3CO2(g)+4H2O(l)...
- 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是①CH3OH(g)+H2O(g)=CO2(g)+3H2(g);△H=+49.0kJ·mol-1②CH...