本试题 “下列事实一定能说明HNO2为弱电解质的是( )①常温下NaNO2溶液的PH>7②10mL1mol/L HNO2恰好与10mL1mol/LNaOH完全反应③HNO2与NaCl不能反应④0.1mol/L HNO2溶液的...” 主要考查您对弱电解质的电离
强电解质、弱电解质
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 弱电解质的电离
- 强电解质、弱电解质
定义:
在一定温度、浓度的条件下,弱电解质在溶液中电离成离子的速率与离子结合成分子的速率相等时,电离过程就到了电离平衡状态,叫弱电解质的电离平衡。

电离平衡的特征:
(1)等:
(2)动: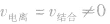 的动态平衡
的动态平衡
(3)定:条件一定,分子与离子浓度一定。
(4)变:条件改变,平衡破坏,发生移动。
在一定温度、浓度的条件下,弱电解质在溶液中电离成离子的速率与离子结合成分子的速率相等时,电离过程就到了电离平衡状态,叫弱电解质的电离平衡。

电离平衡的特征:
(1)等:

(2)动:
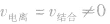 的动态平衡
的动态平衡(3)定:条件一定,分子与离子浓度一定。
(4)变:条件改变,平衡破坏,发生移动。
强电解质:
在水溶液里或熔融状态下,能全部电离的化合物。包括:强酸、强碱、大多数盐、活泼金属氧化物等;完全电离、不可逆、不存在电离平衡;电离方程式用“=”表示。
弱电解质:
在水溶液里或熔融状态下,不能全部电离的化合物。包括:弱酸、弱碱、少数盐等;部分电离、可逆、存在电离平衡,电离方程式用“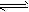 ”表示。
”表示。
在水溶液里或熔融状态下,能全部电离的化合物。包括:强酸、强碱、大多数盐、活泼金属氧化物等;完全电离、不可逆、不存在电离平衡;电离方程式用“=”表示。
弱电解质:
在水溶液里或熔融状态下,不能全部电离的化合物。包括:弱酸、弱碱、少数盐等;部分电离、可逆、存在电离平衡,电离方程式用“
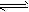 ”表示。
”表示。 强电解质和弱电解质的比较:
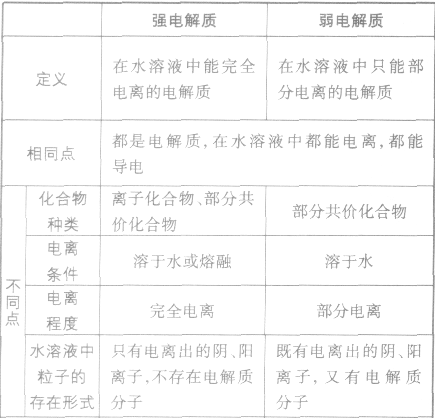
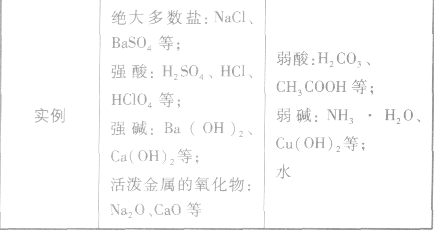
强弱电解质的判断依据:
1.在相同浓度、相同温度下,与强电解质做导电性对比实验.
2.浓度与pH的关系。如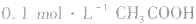 溶液的pH>1,则证明
溶液的pH>1,则证明 是弱电解质。
是弱电解质。
3.测定对应盐溶液的酸碱性。如 溶液呈碱性,则证明醋酸是弱电解质。
溶液呈碱性,则证明醋酸是弱电解质。
4.稀释前后的pH变化与稀释倍数的关系。例如,将pH=2的酸溶液稀释1000倍,若pH<5,则证明该酸为弱电解质;若pH=5,则证明该酸为强电解质。
5.采用实验证明电离平衡。如向醋酸溶液中滴人石蕊试液,溶液变红,再加入醋酸钠晶体,颜色变浅。
发现相似题
与“下列事实一定能说明HNO2为弱电解质的是( )①常温下NaNO2溶液...”考查相似的试题有:
- 25℃,加水稀释10mLpH=11的氨水,下列判断正确的是A.原氨水的浓度=10-3mol /LB.氨水的电离程度增大,溶液中所有离子的浓度...
- 在体积都为1L,pH都等于2的盐酸和醋酸溶液中,投入0.65g大小相同的锌粒,则下列各图比较符合客观事实的是( )A.B.C.D.
- 如图,横坐标表示加水量,纵坐标表示导电能力,能表示冰醋酸(即无水醋酸)加水稀释的图是( )A.B.C.D.
- 在相同温度下,100mL 0.01mol/L醋酸与10mL 0.1mol/L醋酸相比,下列数值前者大于后者的是( )A.中和时所需NaOH的量B.电离程...
- 已知25 ℃时有关弱酸的电离平衡常数如下表:弱酸CH3COOHHCNH2CO3电离平衡常数(25 ℃)1.8×10-54.9×10-10K1=4.3×10-7K2=5.6×10-11 ...
- 甲酸(HCOOH)的下列性质中,可以证明它是弱电解质的是( )A.1mol/L的甲酸溶液的pH约为2B.甲酸能与水以任意比例互溶C.10m...
- 下列说法正确的是( )A.c(H+)=1×10-7mol/L的溶液一定是酸性B.水本身电离出的c(H+)=1×10-13的溶液,可能是0.1mol...
- 下列说法正确的是( )A.强电解质溶液的导电能力一定比弱电解质溶液的强B.氨气是弱电解质,铜是强电解质C.氢氧化钠是强电...
- 下列属于电解质的是A.硫酸溶液B.铜C.NaClD.CO2
- (12分)(1)①水银②烧碱③大理石④氯化钠晶体⑤盐酸⑥氨气⑦蔗糖⑧氯气⑨液态氯化氢⑩硫酸溶液上述物质中能导电的是 ,属于电解质的...