本试题 “下列哪组物质既能与NaOH溶液反应又能与稀盐酸反应的是[ ]A.Al(OH)3、Al、Al2O3、NaHCO3、(NH4)2CO3B.Na、Al、NH4Cl、Al2O3、CuSO4C.Al(OH)3、Na2SiO3、Na2...” 主要考查您对氢氧化钠
氯的其他化合物(高氯酸、氯化物、氯酸盐,盐酸等)
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 氢氧化钠
- 氯的其他化合物(高氯酸、氯化物、氯酸盐,盐酸等)
氢氧化钠:
俗称火碱、烧碱、苛性钠
(1)与酸反应:NaOH+HCl==NaCl+H2O、2NaOH+H2SO4==Na2SO4+2H2O
(2)与非金属氧化物反应:2NaOH+CO2==Na2CO3+H2O、2NaOH+SO2==Na2SO3+H2O 、2NaOH+SO3==Na2SO4+H2O、2NaOH+SiO2==Na2SiO3+H2O
(3)与盐反应:2NaOH+CuCl2==Cu(OH)2+2NaCl
氢氧化钠的物理性质:
氢氧化钠为白色半透明,结晶状固体。其水溶液有涩味和滑腻感。密度:2.130g/cm3,熔点:318.4℃,沸点:1390℃。
溶解性:极易溶于水,溶解时放出大量的热。易溶于水醇、乙醇以及甘油。(氢氧化钠具有潮解性)
吸湿性:固碱吸湿性很强,露放在空气中,最后会完全溶解成溶液。
氢氧化钠的化学性质:
强碱性:
氢氧化钠溶液是常见的强碱,具有碱的通性:
①使酸碱指示剂变色:能使石蕊溶液变蓝,能使酚酞溶液变红;
②与酸发生中和反应生成盐和水;NaOH+HCl=NaCl+H2O
③与某些盐反应生成新盐和新碱;2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
④与酸性氧化物反应生成盐和水。2NaOH+CO2====Na2CO3+H2O
腐蚀性:
氢氧化钠对玻璃制品有轻微的腐蚀性,两者会生成硅酸钠,使得玻璃仪器中的活塞黏着于仪器上。如果以玻璃容器长时间盛装热的氢氧化钠溶液,会造成玻璃容器损坏。
氢氧化钠溶液与CO2的反应规律:
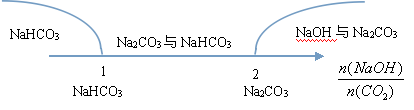
当二氧化碳少量时:2NaOH+CO2(少量)=Na2CO3+H2O
当二氧化碳过量时:Na2CO3+CO2(过量)+H2O=2NaHCO3
当二氧化碳与氢氧化钠的物质的量之比大于1小于2时,生成碳酸钠与碳酸氢钠的混合物。具体各产物的物质的量可根据钠元素守恒和碳元素守恒求算。
常见的氯化物:
(1)高氯酸:高氯酸HClO4,无色透明的发烟液体,在无机酸中酸性最强。可助燃,具强腐蚀性、强刺激性,可致人体灼伤。与有机物、还原剂、易燃物如硫、磷等接触或混合时有引起燃烧爆炸的危险。在室温下分解,加热则爆炸。
(2)氯化物:如氯化钠、氯化钙等,Cl-+Ag+==AgCl↓
(3)次氯酸盐:次氯酸盐是次氯酸的盐,含有次氯酸根离子ClO-,其中氯的氧化态为+1。次氯酸盐常以溶液态存在,不稳定,会发生歧化反应生成氯酸盐和氯化物。见光分解为氯化物和氧气。次氯酸盐是一种常用的漂白剂和消毒剂。在人体组织中,在亚铁血红素的髓过氧化物酶的催化作用下,过氧化物与氯化物反应可产生ClO-或HClO。这种在血球内产生的ClO-/HClO或Cl2
(4)氯酸盐:如氯酸钾在二氧化锰催化下可制取氧气
(5)盐酸:盐酸是氯化氢的水溶液,是一种混合物。纯净的盐酸是无色的液体,有刺激性气味。工业品浓盐酸因含有杂质(Fe3+)带有黄色。浓盐酸具有挥发性,打开浓盐酸的瓶盖在瓶口立即产生白色酸雾。这是因为从浓盐酸中挥发出来的氯化氢气体跟空气中水蒸汽接触,形成盐酸小液滴分散在空气中形成酸雾。
(6)氯化氢:无色或微黄色易挥发性液体,有刺鼻的气味。易溶于水与氨气反应生成氯化铵HCl+NH3==NH4Cl
卤化氢和氢卤酸、卤化银及碘化物:
1.卤化氢物理性质:卤化氢均为无色有刺激性气味的气体,均极易溶于水,在空气中都易形成酸雾。化学性质:从HF—HCl—HBr—HI,稳定性逐渐减弱,HI受热易分解;还原性逐渐增强。
2.氢卤酸:Hx溶于水后形成的溶液即氢卤酸。在氢卤酸中,除氢氟酸是弱酸外,其余皆为强酸。从氢氟酸一氢碘酸,酸性逐渐增强,还原性也逐渐增强,其中氢碘酸在空气中易被氧气氧化。
3.卤化银:

4.碘化物碘是人体必需的微量元素之一,又称“智慧元素”。人体缺碘会导致碘缺乏病(IDD),从而损害人的智力和健康。补碘最经济、方便有效的方法是食用含碘食盐。含碘食盐中加的是碘酸钾。值得注意的是,人体摄入过多的碘也是有害的,不能认为高碘的食物吃得越多越好,要根据个人的身体情况而定。
卤素单质及其化合物的特殊性:
(1)Br2是常温下唯一呈液态的非金属单质,易挥发,蒸气有毒。保存液溴要采用水封法。
(2)碘单质易升华,AgI可用于人工降雨,碘盐可用于防治甲状腺肿大。
(3)HClO4是常见含氧酸中酸性最强的酸,HClO 是氯的含氧酸中氧化性最强的酸。
(4)在卤素中,氯、溴、碘均有多种价态,但氟只有-1价和0价,而无正价。
(5)卤素单质一般不与稀有气体反应,但F,却能与Xe、Kr等稀有气体反应生成相应的氟化物。如 KrF2、XeF2、:XeF4、XeF6等。
(6)Cl2、Br2、I2的实验室制法均可用MnO2与相应的浓的氢卤酸反应制得,但F2不能用上述方法在实验室制得。
(7)卤素单质与水反应,其中Cl2、Br2、I2在反应中既是氧化剂又是还原剂,而F2与水作用时,只作氧化剂。
(8)卤素单质都能与强碱溶液反应,一般可表示为 X2+2OH-==X-+XO-+H2O(F、I除外)。
(9)碘单质遇淀粉呈现特殊蓝色。可用来鉴别碘单质或淀粉。
(10)I2在水中的溶解度很小,若在水中加入少量的KI,碘的溶解度却明显增大,这是因为发生了反应I2 +I-==I3-
(11)卤素单质与Fe作用时,除Fe+I2==FeI2 外,其他均生成+3价铁盐。常温下,干燥的液氯不与 Fe作用,故工业上可用钢瓶盛液氯。
(12)随着相对分子质量的增大,HCl、HBr、HI的熔、沸点逐渐升高。HF的相对分子质量虽比HCl小,其熔、沸点却比HCl高,是因为HF分子间存在氢键。
(13)在氧卤酸中,只有氢氟酸能与玻璃反应:SiO2 +4HF==SiF4↑+2H2O,在实验室制取HF必须在铅皿中进行。
(14)实验室制取HF、HCl分别用CaF2、NaCl与浓硫酸反应,但实验室制取HBr、HI宜用NaBr和KI与浓磷酸反应。因为生成的HBr、HI易被浓硫酸氧化生成Br2或I2。
(15)在卤化银中,AgCl、AgBr、AgI均难溶于水,且见光易分解,但AgF却易溶于水且见光不分解。
与“下列哪组物质既能与NaOH溶液反应又能与稀盐酸反应的是[ ]A.A...”考查相似的试题有:
- 某课外实验小组设计的下列实验不合理的是( )A.制备并观察氢氧化亚铁B.证明过氧化钠与水反应放热C.制备并收集少量NO2气体...
- 25 ml 加入到锥形瓶中,再加入过量的KI溶液和过量的H2SO4溶液,静置。待完全反应后,用0.1 mol/L的Na2S2O3溶液作标准溶液滴定...
- 漂白粉的主要成分是( ) A.次氯酸钙B.氯化钙C.次氯酸D.次氯酸钙与氯化钙
- 二十一世纪世界资源争夺的重点是海洋。海底有石油、可燃冰、石油气、矿砂、锰结核的资源,海水中除有渔业资源外,还有食盐、...
- (6分)在新制氯水的各种微粒中,(1)使氯水呈黄绿色的是(用化学式或离子符号填写,下同) ;(2)能使硝酸银溶液产生白色...
- 某温度下,在体积一定的密闭容器中,适量的NH3和Cl2恰好完全反应。若反应产物只有N2和NH4Cl,则反应前后容器中压强比应接近(...
- (4分)以下是实验室制取氯气的装置,在图中饱和食盐水的作用是 ,浓硫酸的作用是 ,F中盛放的溶液是 ,起的作用是 。
- (16分)某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计...
- 氯化碘(ICl)的化学性质跟氯气相似,预计它跟水反应的最初生成物是A HI、HClO B HCl 、HIO C HClO3、HIO D HClO、HIO
- (1)某溶液中Cl-、Br-、I-三种离子的物质的量之比为1:2:3,要使它们的物质的量之比变为4:3:2,则需通入Cl2的物质的量是原溶...