本试题 “已知反应:①25℃、101kPa时:N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-534kJ•mol-1②稀溶液中:H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ•mol-1下列结论正确...” 主要考查您对中和热
燃烧热
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 中和热
- 燃烧热
中和热:
在稀溶液中,酸和碱发生中和反应生成1molH2O时的反应热。中和热的表示方法: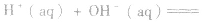
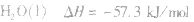
在稀溶液中,酸和碱发生中和反应生成1molH2O时的反应热。中和热的表示方法:
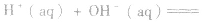
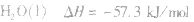
影响中和热测定的因素:
中和反应巾放出的热量为(m1+m1)·c·(t1-t2),其巾溶液的比热容c是已知的,对于给定的反应物的质量m1和m2也是定值,这样求算出的中和热是否接近 57.3kl·mol-1,取决于溶液温度的变化。
在整个实验过程中应把好两关:①隔热关。如:小烧杯周围的泡沫塑料要填满;盖板上两孔只要正好使温度计和环形玻璃搅拌棒通过即可;倒人NaOH溶液要迅速等,尽可能减少实验过程中热量的散失。②准确关。如:配制溶液的浓度要准;NaOH溶液要新制,因为久置的NaOH溶液可能变质导致浓度不准;量取液体体积时读数要准;对溶液温度要读到最高点。
注意事项:
(1)这里的溶液一般要求是稀溶液,这是因为浓酸溶液和浓碱溶液相互稀释时会放出热量
(2)强酸与强碱的反应实质是H+和OH-反应(即与酸、碱的种类无关),通过多次实验测定,1molH+和1molOH-反应生成lmol H2O(l)时,放出的热量为 57.3kJ
(3)中和热是以生成1molH2O为基准的,因此表示中和热的热化学方程式中,水的化学计量数为1,酸、碱的化学计量数可以为分数
燃烧热:
在101kPa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热。单位为kJ/mol
注意事项:
(1)规定是在101kPa 下测出的热量。书中提供的燃烧热数据都是在25℃、101kPa下测定出来的
(2)规定可燃物的物质的量为1mol(这样才有可比性)。因此,表示可燃物的燃烧热的热化学方程式中,可燃物的化学计量数为1,其他物质的化学计量数常出现分数
(3)规定生成稳定的氧化物,例如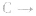
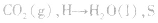
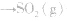 等
等
(4)叙述燃烧热时、不用“+”“-”,在热化学方程式中用△H表示时取“-”
在101kPa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热。单位为kJ/mol
燃烧热和中和热的异同:
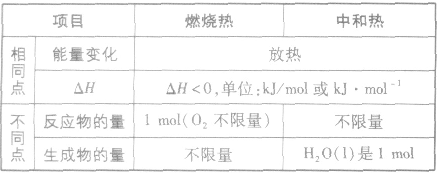
注意事项:
(1)规定是在101kPa 下测出的热量。书中提供的燃烧热数据都是在25℃、101kPa下测定出来的
(2)规定可燃物的物质的量为1mol(这样才有可比性)。因此,表示可燃物的燃烧热的热化学方程式中,可燃物的化学计量数为1,其他物质的化学计量数常出现分数
(3)规定生成稳定的氧化物,例如
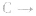
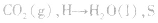
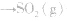 等
等 (4)叙述燃烧热时、不用“+”“-”,在热化学方程式中用△H表示时取“-”
发现相似题
与“已知反应:①25℃、101kPa时:N2H4(g)+O2(g)=N2(g)+2H2O...”考查相似的试题有:
- 已知下列反应的热化学方程式6C(s)+5H2(g)+3N2(g)+9O2(g) 2C3H5(ONO2)3(l) ΔH12 H2(g)+ O2(g) 2H2O(g) ΔH2C(s)+ O2(g) CO2(g) ...
- (1)医疗上常用浓度为75%的某有机物水溶液作皮肤消毒液。该有机物的结构简式是 。(2)一定条件下,0.1mol氨气与氧气反应生...
- (10分)已知 2 mol SO2(g) 氧化为2 mol SO3(g) 的能量变化如图所示:(1)写出SO2(g) 氧化为SO3(g) 的热化学方程式: (2)...
- 已知强酸与强碱在稀溶液中反应的中和热可表示为:H+(aq)+OH-(aq)=H2O(l);ΔH=-57.3kJ·mol-1对于下列反应:CH3COOH(aq)+NaOH(a...
- 能源是影响全球经济和生活的重要因素。目前人类已开发和利用的能源中,氢气是最理想的清洁能源之一。已知反应:2H2+O2 2H2O...
- (8分)甲醇是一种优质燃料,可制作燃料电池。(1)工业上可用下列两种反应制备甲醇:①CO(g) + 2H2(g)CH3OH(g) ΔH1 ②CO2(g)+3H...
- 汽车内燃机工作时产生的电火花和高温会引起反应:N2(g)+O2(g)=2NO(g),导致汽车尾气中的NO和NO2对大气造成污染。(1)在不同...
- 燃煤废气中的氮氧化物(NOx)、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等。(1)对燃煤废气进行脱硝处理...
- 下列热化学方程式中的△H能表示物质燃烧热的是( )A.2 CO(g)+O2(g)=2 CO2(g);△H=-566 KJ•mol-1B.CH4(g)+2 O2(g)...
- 已知反应:① 2C(s)+O2(g)=2CO(g) ΔH=-221 kJ/mol② 稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ/mol下列结论正...