本试题 “在化学学习和研究中分析推理是常用的思维方法.请你判断下列分析推理,正确的是( )A.有机物中都含有碳元素,所以含碳元素的化合物都是有机物B.中和反应生...” 主要考查您对固体溶解度
单质和化合物
有机化合物和无机化合物
中和反应及在实际中的应用
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 固体溶解度
- 单质和化合物
- 有机化合物和无机化合物
- 中和反应及在实际中的应用
概念:
在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里,该温度下的溶解度。
正确理解溶解度概念的要素:
①条件:在一定温度下,影响固体物质溶解度的内因是溶质和溶剂的性质,而外因就是温度。如果温度改变,则固体物质的溶解度也会改变,因此只有指明温度时,溶解度才有意义。
②标准:“在100g溶剂里”,需强调和注意的是:此处100g是溶剂的质量,而不是溶液的质量。
③状态:“达到饱和状态”,溶解度是衡址同一条件下某种物质溶解能力大小的标准,只有达到该条件下溶解的最大值,才可知其溶解度,因此必须要求“达到饱和状态”。
④单位:溶解度是所溶解的质量,常用单位为克(g)。
概念的理解:
①如果不指明溶剂,通常所说的溶解度是指固体物质在水中的溶解度。
②溶解度概念中的四个关键点:“一定温度,100g 溶剂、饱和状态、溶解的质量”是同时存在的,只有四个关键点都体现出来了,溶解度的概念和应用才是有意义的,否则没有意义,说法也是不正确的。
溶解度曲线:
在平面直角坐标系里用横坐标表示温度,纵坐标表示溶解度,画出某物质的溶解度随温度变化的曲线,叫这种物质的溶解度曲线。
①表示意义
a.表示某物质在不同温度下的溶解度和溶解度随温度变化的情况;
b.溶解度曲线上的每一个点表示该溶质在某一温度下的溶解度;
c.两条曲线的交点表示这两种物质在某一相同温度下具有相同的溶解度;
d.曲线下方的点表示溶液是不饱和溶液;
e.在溶解度曲线上方靠近曲线的点表示过饱和溶液(一般物质在较高温度下制成饱和溶液,快速地降到室温,溶液中溶解的溶质的质量超过室温的溶解度,但尚未析出晶体时的溶液叫过饱和溶液)。
②溶解度曲线的变化规律
a.有些固体物质的溶解度受温度影响较大,表现在曲线“坡度”比较“陡”,如KNO3;
b.少数固体物质的溶解度受温度的影响很小,表现在曲线“坡度”比较“平”,如NaCl 。
c.极少数固体物质的溶解度随温度的升高而减小,表现在曲线“坡度”下降,如Ca(OH)2
③应用
a.根据溶解度曲线可以查出某物质在一定温度下的溶解度;
b.可以比较不同物质在同一温度下的溶解度大小;
c.可以知道某物质的溶解度随温度的变化情况;
d.可以选择对混合物进行分离或提纯的方法;
e.确定如何制得某温度时某物质的饱和溶液的方法等。
运用溶解度曲线判断混合物分离、提纯的方法:
根据溶解度曲线受温度变化的影响,通过改变温度或蒸发溶剂,使溶质结晶折出,从而达到混合物分离、提纯的目的。如KNO3和NaCl的混合物的分离。 (KNO3,NaCl溶解度曲线如图)
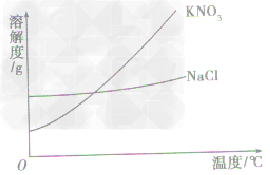
(1)温度变化对物质溶解度影响较大,要提纯这类物质。可采用降温结晶法。
具体的步骤为:①配制高温时的饱和溶液,②降温,③过滤,④干燥。如KNO3中混有少量的NaCl,提纯KNO3可用此法。
(2)温度变化对物质溶解度影响较小,要提纯这类物质,可用蒸发溶剂法。
具体步骤为:①溶解,②蒸发溶剂,③趁热过滤,④干燥。如NaCl中混有少量KNO3,要提纯NaCl,可配制溶液,然后蒸发溶剂,NaCl结晶析出,而KNO3在较高温度下,还没有达到饱和,不会结晶,趁热过滤,可得到较纯净的NaCl。
在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里,该温度下的溶解度。
正确理解溶解度概念的要素:
①条件:在一定温度下,影响固体物质溶解度的内因是溶质和溶剂的性质,而外因就是温度。如果温度改变,则固体物质的溶解度也会改变,因此只有指明温度时,溶解度才有意义。
②标准:“在100g溶剂里”,需强调和注意的是:此处100g是溶剂的质量,而不是溶液的质量。
③状态:“达到饱和状态”,溶解度是衡址同一条件下某种物质溶解能力大小的标准,只有达到该条件下溶解的最大值,才可知其溶解度,因此必须要求“达到饱和状态”。
④单位:溶解度是所溶解的质量,常用单位为克(g)。
概念的理解:
①如果不指明溶剂,通常所说的溶解度是指固体物质在水中的溶解度。
②溶解度概念中的四个关键点:“一定温度,100g 溶剂、饱和状态、溶解的质量”是同时存在的,只有四个关键点都体现出来了,溶解度的概念和应用才是有意义的,否则没有意义,说法也是不正确的。
溶解度曲线:
在平面直角坐标系里用横坐标表示温度,纵坐标表示溶解度,画出某物质的溶解度随温度变化的曲线,叫这种物质的溶解度曲线。
①表示意义
a.表示某物质在不同温度下的溶解度和溶解度随温度变化的情况;
b.溶解度曲线上的每一个点表示该溶质在某一温度下的溶解度;
c.两条曲线的交点表示这两种物质在某一相同温度下具有相同的溶解度;
d.曲线下方的点表示溶液是不饱和溶液;
e.在溶解度曲线上方靠近曲线的点表示过饱和溶液(一般物质在较高温度下制成饱和溶液,快速地降到室温,溶液中溶解的溶质的质量超过室温的溶解度,但尚未析出晶体时的溶液叫过饱和溶液)。
②溶解度曲线的变化规律
a.有些固体物质的溶解度受温度影响较大,表现在曲线“坡度”比较“陡”,如KNO3;
b.少数固体物质的溶解度受温度的影响很小,表现在曲线“坡度”比较“平”,如NaCl 。
c.极少数固体物质的溶解度随温度的升高而减小,表现在曲线“坡度”下降,如Ca(OH)2
③应用
a.根据溶解度曲线可以查出某物质在一定温度下的溶解度;
b.可以比较不同物质在同一温度下的溶解度大小;
c.可以知道某物质的溶解度随温度的变化情况;
d.可以选择对混合物进行分离或提纯的方法;
e.确定如何制得某温度时某物质的饱和溶液的方法等。
运用溶解度曲线判断混合物分离、提纯的方法:
根据溶解度曲线受温度变化的影响,通过改变温度或蒸发溶剂,使溶质结晶折出,从而达到混合物分离、提纯的目的。如KNO3和NaCl的混合物的分离。 (KNO3,NaCl溶解度曲线如图)

(1)温度变化对物质溶解度影响较大,要提纯这类物质。可采用降温结晶法。
具体的步骤为:①配制高温时的饱和溶液,②降温,③过滤,④干燥。如KNO3中混有少量的NaCl,提纯KNO3可用此法。
(2)温度变化对物质溶解度影响较小,要提纯这类物质,可用蒸发溶剂法。
具体步骤为:①溶解,②蒸发溶剂,③趁热过滤,④干燥。如NaCl中混有少量KNO3,要提纯NaCl,可配制溶液,然后蒸发溶剂,NaCl结晶析出,而KNO3在较高温度下,还没有达到饱和,不会结晶,趁热过滤,可得到较纯净的NaCl。
单质:
(1)概念:由同种元素组成的纯净物。
(2)单质的分类:依据组成单质元素的性质把一单质分为三类。
金属单质:由金属元素组成的单质,如铁、铜、银等
非金属单质:由非金属元素组成的单质,如碳、磷、氧气等
稀有气体单质:由稀有气体元素组成的单质,如氦、氖、氛等单质
化合物:
(1)概念:由不同种元素组成的纯净物。
(2)化合物的分类:化合物分为有机化合物和无机化合物。
单质和化合物的区别和联系:
化合物与氧化物的区别和联系:
同种元素组成的物质一定是单质吗?
由同种元素组成的纯净物叫做单质。理解单质的概念必须抓住两点:①由同种元素组成;②必须是纯净物,如氧气是一单质。由同种元素组成的物质不一定是单质,也可能是混合物,但绝不可能是化合物,如氧气 (O2)、臭氧(O3)两种物质混在一起是一种混合物,但是只有一种氧元素;同样的例子还有红磷和白磷,金刚石和石墨等。
对单质和化合物概念的理解:
(1)单质的概念:
①理解一单质的概念不仅要关注它是由一种元素组成,还应注意它首先是一种纯净物。如:氧气、氮气、碳、硫、铁、铜、各种稀有气体等都属于单质。
②由同种元素组成的物质不一定是单质,还可能是混合物:如:氧气与臭氧的混合物、白磷与红磷的混合物、金刚石与石墨的混合物等都只含一种元素,但都属于混合物。
(2)化合物的概念:理解化合物的概念同样不仅要关注它是由两种或两种以上的元素组成,还应注意它首先是一种纯净物。如二氧化碳,氯化钠、高锰酸钾等都属于化合物。
(1)概念:由同种元素组成的纯净物。
(2)单质的分类:依据组成单质元素的性质把一单质分为三类。
金属单质:由金属元素组成的单质,如铁、铜、银等
非金属单质:由非金属元素组成的单质,如碳、磷、氧气等
稀有气体单质:由稀有气体元素组成的单质,如氦、氖、氛等单质
化合物:
(1)概念:由不同种元素组成的纯净物。
(2)化合物的分类:化合物分为有机化合物和无机化合物。
单质和化合物的区别和联系:
| 单质 | 化合物 | ||
| 区别 | 宏观组成 | 同种元素 | 不同种元素 |
| 微观构成 | 有同种原子构成 | 由不同种原子构成 | |
| 化学性质 | 不能发生分解反应 | 一定条件下发生分解反应 | |
| 联系 | 相互转变 | 它们均属于纯净物。单质发生化合反应可以生成化合物,化合物发生分解反应可以生成单质 | |
| 质子数 | 同一种元素的原子,不论在一单质里还是在化合物里,原子核内质子数保持不变 | ||
化合物与氧化物的区别和联系:
| 化合物 | 氧化物 | |
| 区别 | ①由不同种元素组成的纯净物叫化合物 ②由两种或两种以上元素组成 ③不一定含有氧元素 ④属于纯净物中的一类 |
①由两种元素组成的化合物中,如果有一种元素是氧元素,这种化合物叫氧化物 ②一定由两种元素组成 ③一定含有氧元素 ④属于化合物中的一类 |
| 联系 | 氧化物和化合物是个体与总体的关系,氧化物属于化合物中的一类 | |
同种元素组成的物质一定是单质吗?
由同种元素组成的纯净物叫做单质。理解单质的概念必须抓住两点:①由同种元素组成;②必须是纯净物,如氧气是一单质。由同种元素组成的物质不一定是单质,也可能是混合物,但绝不可能是化合物,如氧气 (O2)、臭氧(O3)两种物质混在一起是一种混合物,但是只有一种氧元素;同样的例子还有红磷和白磷,金刚石和石墨等。
对单质和化合物概念的理解:
(1)单质的概念:
①理解一单质的概念不仅要关注它是由一种元素组成,还应注意它首先是一种纯净物。如:氧气、氮气、碳、硫、铁、铜、各种稀有气体等都属于单质。
②由同种元素组成的物质不一定是单质,还可能是混合物:如:氧气与臭氧的混合物、白磷与红磷的混合物、金刚石与石墨的混合物等都只含一种元素,但都属于混合物。
(2)化合物的概念:理解化合物的概念同样不仅要关注它是由两种或两种以上的元素组成,还应注意它首先是一种纯净物。如二氧化碳,氯化钠、高锰酸钾等都属于化合物。
共价化合物与离子化合物的区别:
1. 共价化合物
(1)概念:像HCl、CO2这样以共用电子对结合在一起的化合物为共价化合物。
(2)共价化合物的类型:
①两种非金属原子结合成的化合物,如HCl、CO2等。
②非金属与酸根构成的化合物,如H2SO4、HNO3等。
2. 离子化合物与共价化合物的区别:
离子化合物是由阴、阳离子相互作用形成的化合物;共价化合物是原子间全部以共用电子对结合形成的化合物。离子化合物由离子构成,共价化合物大多数由分子构成。
有机化合物:
(1)概念:通常人们将含有碳元素的化合物称为有机化合物,简称有机物,如甲烷、乙醇、葡萄糖、淀粉等。
(2)组成和结构:有机物都含碳元素,多数含有氢元素,可能还含有氧、氮、氯、硫、磷等元素。有机物中碳原子不仅可以和H,O,Cl,,N等原子直接结合,而且碳原子之间也可以互相连接成链状或环状。原子的排列方式不同,形成有机物的结构就不同,所表现出来的性质也不同。
(3)特点:大多数有机化合物都难溶于水,易溶于有机溶剂,大多数有机化合物受热易分解,且容易燃烧,燃烧产物有CO2和水;绝大多数有机化合物不易导电、熔点低。
(4)分类:
①有机物小分子:相对分了质量较小,如乙醇,甲烷、葡萄糖等。
②有机高分子化合物:简称有机高分子,其相对分子质量比较大,从几万到几十万,甚至高达几百万或更高,如淀粉、蛋白质等。
无机化合物:
(1)概念:无机化合物简称无机物,通常指不含碳元素的化合物,但少数含碳元素的化合物,如CO,CO2, H2CO3,CaCO3等,不具有有机化合物的特点,归在无机化合物中。
(2)分类:无机化合物根据元素组成及在水中离解成的粒子特点分为氧化物、酸、碱,盐。
有机化合物与无机化合物的主要区别:
概念的理解:
像NaCl、H2SO4和NaOH等不含碳元素的化合物称为无机化合物,而少数含碳元素的化合物,如CO,CO2和CaCO3等虽然含有碳元素,但具有无机化合物的特点,也把它们看作无机化合物。有机物一定含有碳元素,但含有碳元素的化合物不一定是有机物。含有碳元素但不属于有机物的化合物主要包括: 碳的氧化物、碳酸、碳酸盐和碳酸氢盐。
(1)概念:通常人们将含有碳元素的化合物称为有机化合物,简称有机物,如甲烷、乙醇、葡萄糖、淀粉等。
(2)组成和结构:有机物都含碳元素,多数含有氢元素,可能还含有氧、氮、氯、硫、磷等元素。有机物中碳原子不仅可以和H,O,Cl,,N等原子直接结合,而且碳原子之间也可以互相连接成链状或环状。原子的排列方式不同,形成有机物的结构就不同,所表现出来的性质也不同。
(3)特点:大多数有机化合物都难溶于水,易溶于有机溶剂,大多数有机化合物受热易分解,且容易燃烧,燃烧产物有CO2和水;绝大多数有机化合物不易导电、熔点低。
(4)分类:
①有机物小分子:相对分了质量较小,如乙醇,甲烷、葡萄糖等。
②有机高分子化合物:简称有机高分子,其相对分子质量比较大,从几万到几十万,甚至高达几百万或更高,如淀粉、蛋白质等。
无机化合物:
(1)概念:无机化合物简称无机物,通常指不含碳元素的化合物,但少数含碳元素的化合物,如CO,CO2, H2CO3,CaCO3等,不具有有机化合物的特点,归在无机化合物中。
(2)分类:无机化合物根据元素组成及在水中离解成的粒子特点分为氧化物、酸、碱,盐。
氧化物,酸,碱,盐的比较:
| 物质类别 | 概念 | 分类 |
| 氧化物 | 由两种元素组成,期中一种是氧元素 | 金属氧化物:由金属元素与氧元素组成,如MgO,Fe2O3等 非金属氧化物:由非金属元素与氧元素组成,如CO2、SO2、H2O等 |
| 酸 | 能离解成氢离子和酸根离子的化合物 | 含氧酸:如H2SO4、H2CO3、HNO3等无氧酸:如HCl,H2S等 |
| 碱 | 由金属离子和氢氧根离子构成的化合物 | 可溶性碱:如NaOH,Ca(OH)2等不溶性碱:如Mg(OH)2、 Fe(OH)3等 |
| 盐 | 由金属离子(或铵根离子)和酸根离子构成的化合物 | 正盐:如NaCl、NH4Cl、Na2CO3,仅由金属离子或钱根离子和酸根离子两部分组成酸式盐:如NaHCO3、NH4HCO3,由金属离子或铵根离子、酸式酸根离子构成碱式盐;如Cu2(OH)2CO3,由金属离子、酸根离子和氢氧根离子构成 |
有机化合物与无机化合物的主要区别:
| 有机化合物 | 无机化合物 | |
| 溶解性 | 多数不溶于水。易溶于有机溶剂 | 有些溶于水而不溶于有机溶剂 |
| 耐热性 | 多数不耐热。熔点较低,一般在400℃ 以下 | 多数耐热,难熔化,熔点一般比较高 |
| 可燃性 | 多数可以燃烧 | 多数不能燃烧 |
概念的理解:
像NaCl、H2SO4和NaOH等不含碳元素的化合物称为无机化合物,而少数含碳元素的化合物,如CO,CO2和CaCO3等虽然含有碳元素,但具有无机化合物的特点,也把它们看作无机化合物。有机物一定含有碳元素,但含有碳元素的化合物不一定是有机物。含有碳元素但不属于有机物的化合物主要包括: 碳的氧化物、碳酸、碳酸盐和碳酸氢盐。
中和反应:
(1)定义:酸跟碱作用生成盐和水的反应,叫做中和反应。
(2)实质:酸中的氢离子与碱中的氢氧根离子作用生成水的过程。
概念理解:
①中和反应一定生成盐和水,但生成盐和水的反应不一定是中和反应。如Fe2O3+6HCl==2FeCl3+3H2O不是中和反应
②中和反应一定是复分解反应,但复分解反应不一定是中和反应。二者的关系是复分解反应包含了中和反应。
探究中和反应是否发生的方法:
酸与碱作用生成盐和水的反应叫中和反应,中和反应一般情况下没有明显的外观现象【H2SO4+ Ba(OH)2==BaSO4↓+2H2O除外】。
探究酸碱发生中和反应的方法有以下几种(以HCl和NaOH反应为例):
1. 指示剂法。先在NaOH溶液中滴加几滴酚酞溶液,溶液显红色,然后再滴加盐酸,观察到红色逐渐消失,则证明NaOH溶液与稀盐酸发生了化学反应。
2. pH试纸法。先用pH试纸测定NaOH溶液的pH,再滴加盐酸,并不断振荡溶液,同时多次测定混合溶液的pH。如果测得pH逐渐变小且小于7,则证明 NaOH溶液与稀盐酸发生了化学反应。
3. 热量变化法。化学反应通常伴随着能量的变化.所以可借助反应前后的温度变化来判断反应的发生。如果NaOH溶液与稀盐酸混合前后温度有变化,则证明发生了化学反应。
中和反应的应用:
①改变土壤的酸碱性根据土壤情况,可以利用中和反应,在土壤中加人适量酸性或碱性物质,调节土壤的酸碱性,以利于植物生长。如:近年来由于空气污染造成的酸雨,导致一些地方的土壤显酸性,不利于农作物生长,人们通常向土壤中撒适量熟石灰中和其酸性。
②处理工厂的废水工厂里排出的废水有一些显酸性或碱性,直接排放会对水体和环境造成污染。通常在排出的废水中加入适量的碱性或酸性物质中和。如:废水中含有硫酸可向其中加人适从熟石灰,反应的化学方程式为:H2SO4+Ca(OH)2==CaSO4+2H2O。
③用于医药人体胃酸(主要成分是盐酸)过多,会造成消化不良,甚至会产生胃病,通常服用呈碱性的物质来消除症状,如氢氧化铝,反应的化学方程式为:3HCl+Al(OH)3== AlCl3+3H2O。被蚊虫叮咬(蚊虫能分泌出蚁酸)后,可在患处涂上显碱胜的物质,如:NH3·H2O。
(1)定义:酸跟碱作用生成盐和水的反应,叫做中和反应。
(2)实质:酸中的氢离子与碱中的氢氧根离子作用生成水的过程。
概念理解:
①中和反应一定生成盐和水,但生成盐和水的反应不一定是中和反应。如Fe2O3+6HCl==2FeCl3+3H2O不是中和反应
②中和反应一定是复分解反应,但复分解反应不一定是中和反应。二者的关系是复分解反应包含了中和反应。
探究中和反应是否发生的方法:
酸与碱作用生成盐和水的反应叫中和反应,中和反应一般情况下没有明显的外观现象【H2SO4+ Ba(OH)2==BaSO4↓+2H2O除外】。
探究酸碱发生中和反应的方法有以下几种(以HCl和NaOH反应为例):
1. 指示剂法。先在NaOH溶液中滴加几滴酚酞溶液,溶液显红色,然后再滴加盐酸,观察到红色逐渐消失,则证明NaOH溶液与稀盐酸发生了化学反应。
2. pH试纸法。先用pH试纸测定NaOH溶液的pH,再滴加盐酸,并不断振荡溶液,同时多次测定混合溶液的pH。如果测得pH逐渐变小且小于7,则证明 NaOH溶液与稀盐酸发生了化学反应。
3. 热量变化法。化学反应通常伴随着能量的变化.所以可借助反应前后的温度变化来判断反应的发生。如果NaOH溶液与稀盐酸混合前后温度有变化,则证明发生了化学反应。
中和反应的应用:
①改变土壤的酸碱性根据土壤情况,可以利用中和反应,在土壤中加人适量酸性或碱性物质,调节土壤的酸碱性,以利于植物生长。如:近年来由于空气污染造成的酸雨,导致一些地方的土壤显酸性,不利于农作物生长,人们通常向土壤中撒适量熟石灰中和其酸性。
②处理工厂的废水工厂里排出的废水有一些显酸性或碱性,直接排放会对水体和环境造成污染。通常在排出的废水中加入适量的碱性或酸性物质中和。如:废水中含有硫酸可向其中加人适从熟石灰,反应的化学方程式为:H2SO4+Ca(OH)2==CaSO4+2H2O。
③用于医药人体胃酸(主要成分是盐酸)过多,会造成消化不良,甚至会产生胃病,通常服用呈碱性的物质来消除症状,如氢氧化铝,反应的化学方程式为:3HCl+Al(OH)3== AlCl3+3H2O。被蚊虫叮咬(蚊虫能分泌出蚁酸)后,可在患处涂上显碱胜的物质,如:NH3·H2O。
发现相似题
与“在化学学习和研究中分析推理是常用的思维方法.请你判断下列...”考查相似的试题有:
- 右图是固体硝酸钾的溶解度曲线,根据要求回答下列问题:(1)硝酸钾溶液中的溶剂是 。(2)从右图溶解度曲线可以得到的信息是_...
- 25℃时,50g水中最多可溶解5gA,60℃时,溶解10gB至少需要100g水.则40℃时,A、B的溶解度关系为( )A.A<BB.A=BC.A>BD.无...
- 如图是A、B两种固体物质的溶解度曲线.(1)在t1℃时,A溶解度比B______(填大或小).(2)在t2℃时,______(填能或不能)配...
- 右图是甲、乙两种物质的溶解度曲线,两个烧杯中各盛有20℃时上述两种物质的饱和溶液.请你通过分析,回答下列问题:(1)溶解...
- 干冰可以用于人工降雨,当飞机撒布干冰后,云层中不会发生的变化是( )A.水分子间的间隔B.水分子运动速率C.二氧化碳分子...
- 科学家成功地利用精密仪器从石墨中分离出单层的石墨片,这是目前世界上人工制得的最薄的材料,如图所示.下列有关石墨片说法...
- 分析推理是化学学习和研究中常用的思维方法.下列分析推理正确的是( )A.水能灭火,所以酒精一旦燃烧应立即用水浇灭B.有机...
- 下列说法正确的是 ( )A.向某种溶液中滴加AgNO3溶液和稀HNO3,产生白色沉淀。该溶液一定是稀盐酸B.可用适量的硝酸钡溶液,...
- 下图中甲、乙、丙是初中化学中常见的物质,图中“—”表示相连的物质之间可以在溶液中发生化学反应,“→”表示由某种物质可转化为...
- 下列几组物质中,相互能反应,并且需要指示剂来判断反应是否完成的是( )A.氢氧化铁和和稀硫酸B.氢氧化钠溶液和稀盐酸C....