本试题 “逻辑推理是一种重要的化学思维方法,以下推理合理的是( )A.氧化物一定含有氧元素,所以KClO3是氧化物B.化学变化往往伴随发光发热等现象,所以有发光发热...” 主要考查您对实验室制取和收集气体的思路
原子结构
氧化物
物理变化和化学变化的特征和判别
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 实验室制取和收集气体的思路
- 原子结构
- 氧化物
- 物理变化和化学变化的特征和判别
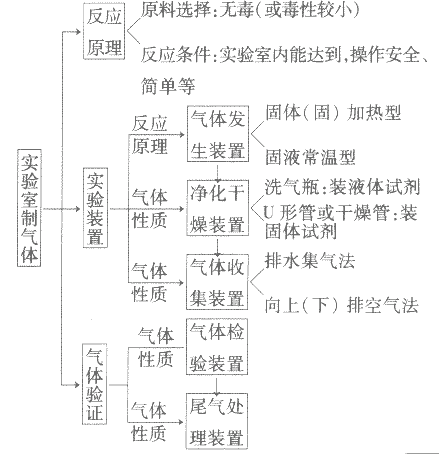
实验室制取气体的思路:
1.知识要点详解在初中化学中,主要应掌握O2、H2、CO2的实验室制法。可以从制备所需仪器、药品、反应原理、收集方法、实验装置、验满、验纯及操作要点等方面进行比较。通过比较,能够总结和归纳实验室制取气体的思路。即:研究反应原理一根据所选药品的状态和反应条件,选择适当的仪器组成相应的实验装置一根据实验装置的特点,设计合理的实验操作步骤,预测可能的注意事项一根据所制取气体的性质,选择相应的收集、检验、验满及验纯的方法。
实验室制取气体及验证其性质的实验,属于基本操作的简单综合实验。通过对比发生装置和收集装置,总结气体的个性及几种气体的共性,提高记忆效果。
2.设计装置的依据制取气体的装置分两部分:气体发生装置和气体收集装置。
发生装置的选取根据反应条件和反应物的状态而设计,收集装置是根据气体的性质(主要是物理性质)而确定的。
确定收集装置的原则——气体的收集方法是由该气体的性质,如密度、在水中的溶解性、是否与空气或水反应、是否有毒等决定的。
气体发生装置:
①“固+固 ”的反应,简称“固体加热型”,装置如图A所示,如用KMnO4或KClO3和MnO2制O2。
”的反应,简称“固体加热型”,装置如图A所示,如用KMnO4或KClO3和MnO2制O2。
②“固+液 ”的反应,简称“固液常温型”,装置如图B、C、D、E。如用H2O2和MnO2制O2、用锌粒与稀H2SO4制H2或用CaCO3与稀盐酸制CO2。同B装置相比,D装置具有便于添加液体药品,制取的气体量较多的优点;C装置不仅添加液体药品方便,而且可通过导管上的开关控制反应的发生和停止;E装置可通过分液漏斗的活塞控制加入药品的量和速度。
”的反应,简称“固液常温型”,装置如图B、C、D、E。如用H2O2和MnO2制O2、用锌粒与稀H2SO4制H2或用CaCO3与稀盐酸制CO2。同B装置相比,D装置具有便于添加液体药品,制取的气体量较多的优点;C装置不仅添加液体药品方便,而且可通过导管上的开关控制反应的发生和停止;E装置可通过分液漏斗的活塞控制加入药品的量和速度。

③“固+液 ”的反应的发生装置的其他改进:
”的反应的发生装置的其他改进:
为了节约药品,方便操作,可设计如下图所示装置,这些装置都可自动控制。
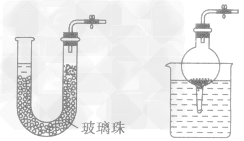
当打开弹簧夹时,溶液进入反应器内开始反应;当关闭弹簧夹时,气路不通,反应产生的气体将溶液压出反应器外,液体与同体分离,反应停止。
气体收集装置:
药品的选取和实验方案的设计:
(1)可行性:所选取的药品能制得要制取的气体;
(2)药品廉价易得;
(3)适宜的条件:要求反应条件易达到,便于控制;
(4)反应速率适中:反应速率不能太快或太慢,以便于收集或进行实验;
(5)气体尽量纯净;
(6)注意安全性:操作简便易行,注意防止污染。
例如:①实验室制取H2时选用锌粒,而不用镁条、铁片,原因是镁价格贵且反应速率太快而铁反应速率又太慢;酸选用稀硫酸,而不宜用稀盐酸、浓硫酸,因为用稀盐酸制得的H2,因混有HCl而不纯,而锌与浓硫酸反应不生成H2.
②制CO2时可选用用石灰石(或大理石)与稀盐酸,而不选用Na2CO3浓盐酸、稀硫酸,原因是Na2CO3,反应速率太快,浓盐酸易挥发出HCl气体,稀硫酸反应不能进行到底,也不能煅烧石灰石,因为条件不易达到,不呵操作;
④用KClO3、过氧化氢制O2时,要加少量的MnO2,作催化剂,以加快反应的速率
实验室制取气体的实验操作程序:
实验室制取气体存选择好药品、仪器后操作的一般程序:
(1)组装仪器:一般按从左到右,从下到上的顺序进行;
(2)检查装置气密;
(3)装药品:若是固体跟液体反应,一般是是先装入固体再加入液体;
(4)准备收集装置:若用排水法收集气体时,应在制取气体之前将集气瓶盛满水;
(5)制取气体;
(6)收集气体并验满;
(7)拆洗仪器。
注意:①给同体加热时.试管口要略向下倾斜;
②用加热KMnO4或KClO3(MnO2作催化剂)的方法制取O2,若用排水法收集,实验完毕时应先把导管移出水槽再移走酒精灯;
③固体跟液体反应制取气体时,要注意长颈漏斗末端要插入液面以下进行液封,以防漏气。
装置的选取与连接:
实验室制取气体的实验往往与气体的净化、气体的干燥综合在一起。气体综合实验的装置选择及连接顺序为:
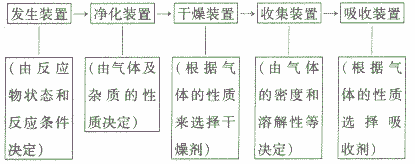
气体净化的几种方法:
(1)吸收法:用吸收剂将杂质气体吸收除去。如除去CO中混有的少量CO2,可先用浓NaOH溶液吸收CO2,再用浓硫酸等干燥剂除去水蒸气。常用吸收剂如下表:
(2)转化法:通过化学反血,将杂质气体转化为所要得到的气体:如除去CO2中的CO,可将混合气体通过足量的灼热CuO+CO Cu+CO2
Cu+CO2
气体的干燥:
气体的干燥是通过干燥剂来实现的,选择干燥剂要根据气体的性质。一般原则是:酸性干燥剂不能用来干燥碱性气体,碱性干燥剂不能用来干燥酸性气体,干燥装置由干燥剂的状念决定.
(1)常见的干燥剂
(2)干燥装置的选择
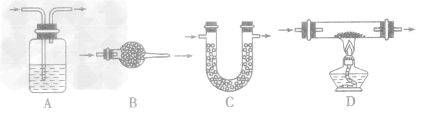
①除杂试剂为液体时,常选用洗气瓶,气体一般是 “长进短出”,如下图A。
②除杂试剂为同体时,常选用干燥管(球形或u 形),气体一般是“大进小出”,如下图B、C。
③需要通过加热与固体试剂发生化学反应除去的气体,常采用硬质玻璃管和酒精灯,如下图D。
装置连接顺序的确定规律:
(1)除杂和干燥的先后顺序
①若用洗气装置除杂,一般除杂在前,干燥在后。原因:从溶液中出来的气体通常混有水蒸气,干燥在后可将水蒸气完全除去。如除去CO中混有的CO2和水蒸气,应将气体先通过。NaOH溶液,再通过浓H2SO4。
②若用加热装置除杂,一般是干燥在前,除杂在后。如除去CO2中混有的CO和水蒸气,应将气体先通过浓H2SO4,再通过灼热的CuO。
(2)除去多种杂质气体的顺序一般是先除去酸性较强的气体。如N2中混有 HCl、H2O(气)、O2时,应先除去HCl,再除去水,最后除去O2(用灼热的铜网)。
(3)检验多种气体的先后顺序(一般先验水蒸气):有多种气体需要检验时,应尽量避免前步检验对后步检验的干扰。如被检验的气体中含有CO2和水蒸气时,应先通过无水CuSO4。检验水蒸气,再通过澄清的石灰水检验CO2.
确定气体收集方法的技巧:
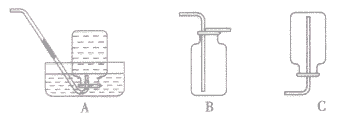
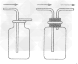
(1)排水集气法适用于“不溶于水且小与水反应的气体”,如下图A。
(2)向上排空气法适用于“密度比空气大且小与空气成分反应的气体”(相对分子质量大于29的气体),如下图B。
(3)向下排空气法适用于“密度比空气小且小与空气成分反应的气体”(相对分子质量小于29的气体),如下图C。
(4)不能用排空气法收集的气体
①气体的密度与空气的密度相近时不能用排空气法收集
②当气体与空气中某一成分反应时不能用排空气法收集
(5)有毒气体收集方法的确定
①有毒,但气体难溶于水时,一般采用排水法收集。如下图D
②有毒,但气体叉易溶于水时,则采用带双孔胶塞(一长一短的导气管)的集气瓶利用排空气法收集该气体,但必须接尾气处理装置,以免多余的有毒气体逸散到空气中污染空气,如收集氨气可用图E。

气体制取实验中关于仪器或装置选择题目的解题技巧:
(1)需要研究气体实验室制法的化学反应原理;
(2)需要研究制取这种气体所应采用的实验装置;
(3)需要研究如何证明制得的气体就是要制取的气体。
根据给出的仪器或装置进行选取时,应明确制取气体的发生装置主要是两套(同体加热型和固液常温型),依据反应物的状态和反应条件来确定选用哪套发生装置;气体的收集装置主要就是三套(向上排空气法、向下排空气法和排水法),依据气体的性质来确定选用什么样的收集装置。选择仪器时要注意先对实验原理进行判断,然后再根据原理确定装置所需要的仪器。
实验室制取气体的思路图:
1.知识要点详解在初中化学中,主要应掌握O2、H2、CO2的实验室制法。可以从制备所需仪器、药品、反应原理、收集方法、实验装置、验满、验纯及操作要点等方面进行比较。通过比较,能够总结和归纳实验室制取气体的思路。即:研究反应原理一根据所选药品的状态和反应条件,选择适当的仪器组成相应的实验装置一根据实验装置的特点,设计合理的实验操作步骤,预测可能的注意事项一根据所制取气体的性质,选择相应的收集、检验、验满及验纯的方法。
实验室制取气体及验证其性质的实验,属于基本操作的简单综合实验。通过对比发生装置和收集装置,总结气体的个性及几种气体的共性,提高记忆效果。
2.设计装置的依据制取气体的装置分两部分:气体发生装置和气体收集装置。
发生装置的选取根据反应条件和反应物的状态而设计,收集装置是根据气体的性质(主要是物理性质)而确定的。
确定收集装置的原则——气体的收集方法是由该气体的性质,如密度、在水中的溶解性、是否与空气或水反应、是否有毒等决定的。
气体发生装置:
①“固+固
 ”的反应,简称“固体加热型”,装置如图A所示,如用KMnO4或KClO3和MnO2制O2。
”的反应,简称“固体加热型”,装置如图A所示,如用KMnO4或KClO3和MnO2制O2。 ②“固+液
 ”的反应,简称“固液常温型”,装置如图B、C、D、E。如用H2O2和MnO2制O2、用锌粒与稀H2SO4制H2或用CaCO3与稀盐酸制CO2。同B装置相比,D装置具有便于添加液体药品,制取的气体量较多的优点;C装置不仅添加液体药品方便,而且可通过导管上的开关控制反应的发生和停止;E装置可通过分液漏斗的活塞控制加入药品的量和速度。
”的反应,简称“固液常温型”,装置如图B、C、D、E。如用H2O2和MnO2制O2、用锌粒与稀H2SO4制H2或用CaCO3与稀盐酸制CO2。同B装置相比,D装置具有便于添加液体药品,制取的气体量较多的优点;C装置不仅添加液体药品方便,而且可通过导管上的开关控制反应的发生和停止;E装置可通过分液漏斗的活塞控制加入药品的量和速度。 
③“固+液
 ”的反应的发生装置的其他改进:
”的反应的发生装置的其他改进:为了节约药品,方便操作,可设计如下图所示装置,这些装置都可自动控制。

当打开弹簧夹时,溶液进入反应器内开始反应;当关闭弹簧夹时,气路不通,反应产生的气体将溶液压出反应器外,液体与同体分离,反应停止。
气体收集装置:
| 收集装置 | 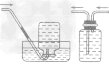 |
 |
 |
| 选择条件 | 难溶或微溶于水,与水不发生化学反应的气体。如:H2、 O2、CH4等 | 不与空气发生反应,密度比空气密度大的气体。如:O2、 CO2等 | 不与空气发生反应,密度比空气密度小的气体。如:H2、CH4等 |
| 说明 | ①使用排水法收集的气体较纯净,但缺点是会使收集的气体中禽有水蒸气。当导管口有连续均匀的气泡冒出时才开始收集,当有大量气泡从集气瓶口冒出时,表明气体已收集满。 ②用向上排空气法收集气体,应注意将导管伸到接近集气瓶瓶底,同时应在瓶口盖上玻璃片,以便尽可能地排尽空气,提高所收集气体的纯度。使用排空气法收集的气体比较十燥,但纯度较低,需要验满(可燃性气体则要注意安全,点燃之前一定要验纯,否则有爆炸危险) | ||
药品的选取和实验方案的设计:
(1)可行性:所选取的药品能制得要制取的气体;
(2)药品廉价易得;
(3)适宜的条件:要求反应条件易达到,便于控制;
(4)反应速率适中:反应速率不能太快或太慢,以便于收集或进行实验;
(5)气体尽量纯净;
(6)注意安全性:操作简便易行,注意防止污染。
例如:①实验室制取H2时选用锌粒,而不用镁条、铁片,原因是镁价格贵且反应速率太快而铁反应速率又太慢;酸选用稀硫酸,而不宜用稀盐酸、浓硫酸,因为用稀盐酸制得的H2,因混有HCl而不纯,而锌与浓硫酸反应不生成H2.
②制CO2时可选用用石灰石(或大理石)与稀盐酸,而不选用Na2CO3浓盐酸、稀硫酸,原因是Na2CO3,反应速率太快,浓盐酸易挥发出HCl气体,稀硫酸反应不能进行到底,也不能煅烧石灰石,因为条件不易达到,不呵操作;
④用KClO3、过氧化氢制O2时,要加少量的MnO2,作催化剂,以加快反应的速率
实验室制取气体的实验操作程序:
实验室制取气体存选择好药品、仪器后操作的一般程序:
(1)组装仪器:一般按从左到右,从下到上的顺序进行;
(2)检查装置气密;
(3)装药品:若是固体跟液体反应,一般是是先装入固体再加入液体;
(4)准备收集装置:若用排水法收集气体时,应在制取气体之前将集气瓶盛满水;
(5)制取气体;
(6)收集气体并验满;
(7)拆洗仪器。
注意:①给同体加热时.试管口要略向下倾斜;
②用加热KMnO4或KClO3(MnO2作催化剂)的方法制取O2,若用排水法收集,实验完毕时应先把导管移出水槽再移走酒精灯;
③固体跟液体反应制取气体时,要注意长颈漏斗末端要插入液面以下进行液封,以防漏气。
装置的选取与连接:
实验室制取气体的实验往往与气体的净化、气体的干燥综合在一起。气体综合实验的装置选择及连接顺序为:

气体净化的几种方法:
(1)吸收法:用吸收剂将杂质气体吸收除去。如除去CO中混有的少量CO2,可先用浓NaOH溶液吸收CO2,再用浓硫酸等干燥剂除去水蒸气。常用吸收剂如下表:
| 吸收剂 | 吸收的气体杂质 | 吸收剂 | 吸收的气体杂质 |
| 水 | 可溶性的气体:HCl,NH3 | NaOH | CO2,HCl,H2O |
| 无水CuSO4 | H2O | 碱石灰 | CO2,HCl ,H2O |
| 灼热的铜网 | O2 | NaOH | CO2,HCl |
| 灼热的CuO | H2,CO | 浓硫酸 | H2O |
 Cu+CO2
Cu+CO2气体的干燥:
气体的干燥是通过干燥剂来实现的,选择干燥剂要根据气体的性质。一般原则是:酸性干燥剂不能用来干燥碱性气体,碱性干燥剂不能用来干燥酸性气体,干燥装置由干燥剂的状念决定.
(1)常见的干燥剂
| 干燥剂 | 可干燥的气体 | 不可干燥的气体 | ||
| 名称或化学式 | 酸碱性 | 状态 | ||
| 浓H2SO4 | 酸性 | 液体 | H2、N2、O2、CO2、HCl、CH4、CO | NH3 |
| 固体NaOH、生石灰,碱石灰(氢氧化钠和生石灰的混合物) | 碱性 | 固态 | H2、O2、N2、CH4、CO、NH3等 | CO2、SO2、HCl |
| 无水CaCl2 | 中性 | 固态 | 除NH3外的所有气体 | NH3 |
(2)干燥装置的选择
①除杂试剂为液体时,常选用洗气瓶,气体一般是 “长进短出”,如下图A。
②除杂试剂为同体时,常选用干燥管(球形或u 形),气体一般是“大进小出”,如下图B、C。
③需要通过加热与固体试剂发生化学反应除去的气体,常采用硬质玻璃管和酒精灯,如下图D。

装置连接顺序的确定规律:
(1)除杂和干燥的先后顺序
①若用洗气装置除杂,一般除杂在前,干燥在后。原因:从溶液中出来的气体通常混有水蒸气,干燥在后可将水蒸气完全除去。如除去CO中混有的CO2和水蒸气,应将气体先通过。NaOH溶液,再通过浓H2SO4。
②若用加热装置除杂,一般是干燥在前,除杂在后。如除去CO2中混有的CO和水蒸气,应将气体先通过浓H2SO4,再通过灼热的CuO。
(2)除去多种杂质气体的顺序一般是先除去酸性较强的气体。如N2中混有 HCl、H2O(气)、O2时,应先除去HCl,再除去水,最后除去O2(用灼热的铜网)。
(3)检验多种气体的先后顺序(一般先验水蒸气):有多种气体需要检验时,应尽量避免前步检验对后步检验的干扰。如被检验的气体中含有CO2和水蒸气时,应先通过无水CuSO4。检验水蒸气,再通过澄清的石灰水检验CO2.
确定气体收集方法的技巧:
(1)排水集气法适用于“不溶于水且小与水反应的气体”,如下图A。
(2)向上排空气法适用于“密度比空气大且小与空气成分反应的气体”(相对分子质量大于29的气体),如下图B。
(3)向下排空气法适用于“密度比空气小且小与空气成分反应的气体”(相对分子质量小于29的气体),如下图C。

(4)不能用排空气法收集的气体
①气体的密度与空气的密度相近时不能用排空气法收集
②当气体与空气中某一成分反应时不能用排空气法收集
(5)有毒气体收集方法的确定
①有毒,但气体难溶于水时,一般采用排水法收集。如下图D
②有毒,但气体叉易溶于水时,则采用带双孔胶塞(一长一短的导气管)的集气瓶利用排空气法收集该气体,但必须接尾气处理装置,以免多余的有毒气体逸散到空气中污染空气,如收集氨气可用图E。

气体制取实验中关于仪器或装置选择题目的解题技巧:
(1)需要研究气体实验室制法的化学反应原理;
(2)需要研究制取这种气体所应采用的实验装置;
(3)需要研究如何证明制得的气体就是要制取的气体。
根据给出的仪器或装置进行选取时,应明确制取气体的发生装置主要是两套(同体加热型和固液常温型),依据反应物的状态和反应条件来确定选用哪套发生装置;气体的收集装置主要就是三套(向上排空气法、向下排空气法和排水法),依据气体的性质来确定选用什么样的收集装置。选择仪器时要注意先对实验原理进行判断,然后再根据原理确定装置所需要的仪器。
实验室制取气体的思路图:

原子的构成:

原子核的构成:

原子核相对原子来说,体积很小,但质量却很大,原子的质量主要集中在原子核上,电子的质量约为质子质量的 。
。
质子的质量为:1.6726×10-27kg
中子的质量为:1.6749×10-27kg
构成原子的粒子间的关系:

对原子构成的正确理解:
(1)原子核位于原子中心,绝大多数由质子和中构成 (有一种氢原子的原子核内只含有1个质子,无中子),体积极小,密度极大,几乎集中了原子的全部质量,核外电子质量很小,可以忽略不计。
(2)每个原子只有一个原子核,核电荷数(核内质子数)的多少,决定了原了的种类。
(3)在原子中:核电荷数二质子数二核外电子数。
(4)原子核内的质子数不一定等干中子数,如钠原子中,质子数为11,中子数为12。
(5)并不是所有的原子中都有中子,如有一种氢原子中就没有中子。
(6)在原子中,由于质子(原子核)与电子所带电荷数相等,且电性相反,因而原子中虽然存在带电的粒子,但原子在整体上不显电性。
核外电子的排布:
①电子层核外电子运动有自己的特点,在含有多个电子的原子里,有的电子通常在离核较近的区域运动,有的电子通常在离核较远的区域运动,科学家形象地将这些区域称为电子层。
②核外电子的分层排布通常用电子层来形象地表示运动着的电子离核远近的不同:离核越近,电子能量越低;离核越远,电子能量越高。电子层数、离核远近、能量高低的关系如下所示:
电子层数 1 2 3 4 5 6 7
离核远近 近→ 远
能量高低 低→ 高
③核外电子排布的规律了解一些核外电子排布的简单规律对理解原子核外电子排布的情况有很重要的作川,核外电子排布的简单规律主要有:
a.每层上的电子数最多不超过2n2(n为电子层数),如第一电子层上的电子数可能为1,也可能为2,但最多为2。
b.核外电子排布时先排第一层,排满第一层后,再排第二层,依次类推。
c.最外层上的电子数不超过8;当只有一个电子层时,最外层上的电子数不超过2。

原子的不可再分与原子的结构:
化学变化中原子不会由一种原子变成另外一种原子,即化学变化中原了的种类不变,其原因是化学变化中原子核没有发生变化。如硫燃烧生成了二氧化硫,硫和氧气中分别含有硫原子和氧原子,反应后生成的二氧化硫中仍然含硫原子和氧原子。原子不是最小粒子,只是在化学变化的范围内为“最小粒子”,它还可再分,如原子弹爆炸时的核裂变,就是原子发生了变化。原子尽管很小,但具有一定的构成,是由居于原子中心的带正电的原子核和核外带负电的电子构成的。

原子核的构成:

原子核相对原子来说,体积很小,但质量却很大,原子的质量主要集中在原子核上,电子的质量约为质子质量的
 。
。质子的质量为:1.6726×10-27kg
中子的质量为:1.6749×10-27kg
构成原子的粒子间的关系:

对原子构成的正确理解:
(1)原子核位于原子中心,绝大多数由质子和中构成 (有一种氢原子的原子核内只含有1个质子,无中子),体积极小,密度极大,几乎集中了原子的全部质量,核外电子质量很小,可以忽略不计。
(2)每个原子只有一个原子核,核电荷数(核内质子数)的多少,决定了原了的种类。
(3)在原子中:核电荷数二质子数二核外电子数。
(4)原子核内的质子数不一定等干中子数,如钠原子中,质子数为11,中子数为12。
(5)并不是所有的原子中都有中子,如有一种氢原子中就没有中子。
(6)在原子中,由于质子(原子核)与电子所带电荷数相等,且电性相反,因而原子中虽然存在带电的粒子,但原子在整体上不显电性。
核外电子的排布:
①电子层核外电子运动有自己的特点,在含有多个电子的原子里,有的电子通常在离核较近的区域运动,有的电子通常在离核较远的区域运动,科学家形象地将这些区域称为电子层。
②核外电子的分层排布通常用电子层来形象地表示运动着的电子离核远近的不同:离核越近,电子能量越低;离核越远,电子能量越高。电子层数、离核远近、能量高低的关系如下所示:
电子层数 1 2 3 4 5 6 7
离核远近 近→ 远
能量高低 低→ 高
③核外电子排布的规律了解一些核外电子排布的简单规律对理解原子核外电子排布的情况有很重要的作川,核外电子排布的简单规律主要有:
a.每层上的电子数最多不超过2n2(n为电子层数),如第一电子层上的电子数可能为1,也可能为2,但最多为2。
b.核外电子排布时先排第一层,排满第一层后,再排第二层,依次类推。
c.最外层上的电子数不超过8;当只有一个电子层时,最外层上的电子数不超过2。

原子的不可再分与原子的结构:
化学变化中原子不会由一种原子变成另外一种原子,即化学变化中原了的种类不变,其原因是化学变化中原子核没有发生变化。如硫燃烧生成了二氧化硫,硫和氧气中分别含有硫原子和氧原子,反应后生成的二氧化硫中仍然含硫原子和氧原子。原子不是最小粒子,只是在化学变化的范围内为“最小粒子”,它还可再分,如原子弹爆炸时的核裂变,就是原子发生了变化。原子尽管很小,但具有一定的构成,是由居于原子中心的带正电的原子核和核外带负电的电子构成的。
氧化物:
1.定义:由两种元素组成,其中一种是氧元素的化合物(即由氧元素和另一种元素组成的化合物)。
2.分类:
(1)根据组成分类:
金属氧化物,如Na2O,CuO等
非金属氧化物,如CO2,NO等
(2)根据性质分类:
①酸性氧化物
能和碱反应生成盐和水的氧化物如CO2,SO3等
②碱性氧化物
能和酸反应生成盐和水的氧化物如CaO、Fe2O3等
③两性氧化物(初中不作要求)
④不成盐氧化物
不能直接反应生成盐的氧化物如CO,NO等
金属氧化物性质小结:
1.与水反应生成碱(可溶性金属氧化物)
Na2O+H2O==2NaOH
CaO+H2O==Ca(OH)2
2.与强酸反应
CaO+2HCI==CaCl2+H2O
Fe2O3+6HCl==2FeCl3+3H2O
Fe2O3+3H2SO4==Fe2(SO)3+3H2O
CuO+2HCl==CuCl2+H2O
CuO+H2SO4==CuSO4+H2O
3.与H2、CO或C反应
CuO+H2==Cu+H2O
2CuO+C==2Cu+CO2↑
CuO+CO==Cu+CO2
Fe2O3+3H2==2Fe+3H2O
2Fe2O3+3C==4Fe+3CO2↑
Fe2O3+3CO==2Fe+3CO2
Fe3O4+4H2==3Fe+4H2O
Fe3O4+2C==3Fe+2CO2↑
Fe3O4+4CO==3Fe+4CO2
非金属氧化物性质小结:
1.部分非金属氧化物与水反应生成相应的酸
CO2+H2O==H2CO3
SO2+H2O==H2SO3
2.与碱反应生成盐和水
Ca(OH)2+CO2==CaCO3↓+H2O
2NaOH+CO2==Na2CO3+H2O
Ca(OH)2+SO2==CaSO3↓+H2O
2NaOH+SO2==Na2SO3+H2O
易错点:
①酸性氧化物多数是非金属氧化物,但也可能是金属氧化物(如Mn2O7);碱性氧化物肯定是金属氧化物。
②非金属氧化物一般都是酸性氧化物,但H2O、CO、NO等不是酸性氧化物。
过氧化物:
常见的过氧化物有过氧化氢(H2O2)、过氧化钠 (Na2O2)。
过氧化氢俗称双氧水,在催化剂的催化作用下能分解生成水和氧气,常用于实验室制取氧气。过氧化氢具有极强的氧化性,可用作杀菌剂,漂白剂。
过氧化钠能与二氧化碳反应:2Na2O2+2CO2== 2Na2CO3+O2,根据该性质,可将过氧化钠用在坑道、潜艇或宁宙飞船等缺氧的场所,将人们呼出的CO2转换成O2,供给呼吸。
1.定义:由两种元素组成,其中一种是氧元素的化合物(即由氧元素和另一种元素组成的化合物)。
2.分类:
(1)根据组成分类:
金属氧化物,如Na2O,CuO等
非金属氧化物,如CO2,NO等
(2)根据性质分类:
①酸性氧化物
能和碱反应生成盐和水的氧化物如CO2,SO3等
②碱性氧化物
能和酸反应生成盐和水的氧化物如CaO、Fe2O3等
③两性氧化物(初中不作要求)
④不成盐氧化物
不能直接反应生成盐的氧化物如CO,NO等
金属氧化物性质小结:
1.与水反应生成碱(可溶性金属氧化物)
Na2O+H2O==2NaOH
CaO+H2O==Ca(OH)2
2.与强酸反应
CaO+2HCI==CaCl2+H2O
Fe2O3+6HCl==2FeCl3+3H2O
Fe2O3+3H2SO4==Fe2(SO)3+3H2O
CuO+2HCl==CuCl2+H2O
CuO+H2SO4==CuSO4+H2O
3.与H2、CO或C反应
CuO+H2==Cu+H2O
2CuO+C==2Cu+CO2↑
CuO+CO==Cu+CO2
Fe2O3+3H2==2Fe+3H2O
2Fe2O3+3C==4Fe+3CO2↑
Fe2O3+3CO==2Fe+3CO2
Fe3O4+4H2==3Fe+4H2O
Fe3O4+2C==3Fe+2CO2↑
Fe3O4+4CO==3Fe+4CO2
非金属氧化物性质小结:
1.部分非金属氧化物与水反应生成相应的酸
CO2+H2O==H2CO3
SO2+H2O==H2SO3
2.与碱反应生成盐和水
Ca(OH)2+CO2==CaCO3↓+H2O
2NaOH+CO2==Na2CO3+H2O
Ca(OH)2+SO2==CaSO3↓+H2O
2NaOH+SO2==Na2SO3+H2O
易错点:
①酸性氧化物多数是非金属氧化物,但也可能是金属氧化物(如Mn2O7);碱性氧化物肯定是金属氧化物。
②非金属氧化物一般都是酸性氧化物,但H2O、CO、NO等不是酸性氧化物。
过氧化物:
常见的过氧化物有过氧化氢(H2O2)、过氧化钠 (Na2O2)。
过氧化氢俗称双氧水,在催化剂的催化作用下能分解生成水和氧气,常用于实验室制取氧气。过氧化氢具有极强的氧化性,可用作杀菌剂,漂白剂。
过氧化钠能与二氧化碳反应:2Na2O2+2CO2== 2Na2CO3+O2,根据该性质,可将过氧化钠用在坑道、潜艇或宁宙飞船等缺氧的场所,将人们呼出的CO2转换成O2,供给呼吸。
物理变化:
1. 定义:没有生成其他物质的变化
2. 实例:灯泡发光,冰融化成水;水蒸发变成水蒸气;碘,干冰的升华,汽油挥发,蜡烛熔化等都是物理变化。
化学变化:
1. 定义:物质发生变化时生成其他物质的变化。
2. 实例:木条燃烧,铁生锈,食物腐烂
3. 现象:化学变化在生成新物质的同时,时常伴随着一些反应现象,表现为颜色改变,放出气体,生成沉淀等,化学变化不但生成其他物质,而且哈伴随着能量的变化,这种能量变化常表现为吸热,放热,发光等。
物理变化概念的理解:
(1)扩散,聚集,膨胀,压缩,挥发,摩擦生热,升温,活性炭吸附氯气等都是物理变化
(2)石墨在一定条件下变成金刚石不是物理变化而是化学变化,因为变成了另一种物质
(3)物理变化前后,物质的种类不变,组成不变,化学性质不变
(4)物理变化的实质是分子的聚集状态发生了改变,导致物质的外形或状态随之改变。
成语、俗语、古诗词蕴含的化学知识
(1)成语、俗语中的变化
①物理变化:只要功夫深,铁柞磨成针;
冰冻三尺非一日之寒;
木已成舟;滴水成冰;花香四溢等。
②化学变化:百炼成钢、点石成金、蜡炬成灰等。
(2)古诗词中的变化于谦的《石灰吟》:
千锤万凿出深山—物理变化
烈火焚烧若等闲—化学变化
粉身碎骨浑不怕—化学变化
要留清白在人间—化学变化
物质的三态变化
(1)物态变化是指同一种物质可在固态,气态,液态三种状态发生转化的过程,如下图,物态变化过程没有新物质生成,属于物理变化。

(2)物态变化过程中的名称和热量变化
1. 定义:没有生成其他物质的变化
2. 实例:灯泡发光,冰融化成水;水蒸发变成水蒸气;碘,干冰的升华,汽油挥发,蜡烛熔化等都是物理变化。
化学变化:
1. 定义:物质发生变化时生成其他物质的变化。
2. 实例:木条燃烧,铁生锈,食物腐烂
3. 现象:化学变化在生成新物质的同时,时常伴随着一些反应现象,表现为颜色改变,放出气体,生成沉淀等,化学变化不但生成其他物质,而且哈伴随着能量的变化,这种能量变化常表现为吸热,放热,发光等。
物理变化:
1. 特征:没有新物质生成。
2. 微观实质:分子本身没有变(对于由分子构成的物质),主要指形状改变或三态变化。
化学变化:
1. 特征:有新物质生成
2. 微观实质:物质发生化学变化时,反应物的分子在化学反应中分成了原子,原子重新组成构成新分子。
物理变化概念的理解:
(1)扩散,聚集,膨胀,压缩,挥发,摩擦生热,升温,活性炭吸附氯气等都是物理变化
(2)石墨在一定条件下变成金刚石不是物理变化而是化学变化,因为变成了另一种物质
(3)物理变化前后,物质的种类不变,组成不变,化学性质不变
(4)物理变化的实质是分子的聚集状态发生了改变,导致物质的外形或状态随之改变。
成语、俗语、古诗词蕴含的化学知识
(1)成语、俗语中的变化
①物理变化:只要功夫深,铁柞磨成针;
冰冻三尺非一日之寒;
木已成舟;滴水成冰;花香四溢等。
②化学变化:百炼成钢、点石成金、蜡炬成灰等。
(2)古诗词中的变化于谦的《石灰吟》:
千锤万凿出深山—物理变化
烈火焚烧若等闲—化学变化
粉身碎骨浑不怕—化学变化
要留清白在人间—化学变化
物质的三态变化
(1)物态变化是指同一种物质可在固态,气态,液态三种状态发生转化的过程,如下图,物态变化过程没有新物质生成,属于物理变化。

(2)物态变化过程中的名称和热量变化
| 变化过程 | 名称 | 热量变化 |
| 固态→气态 | 升华 | 吸热 |
| 气态→固态 | 凝华 | 放热 |
| 固态→液态 | 熔化 | 吸热 |
| 液态→固态 | 凝固 | 放热 |
| 液态→气态 | 汽化 | 吸热 |
| 气态→液态 | 液化 | 放热 |
发现相似题
与“逻辑推理是一种重要的化学思维方法,以下推理合理的是( )A...”考查相似的试题有:
- 小明通过有关资料得知在宇宙飞船上可以安装盛有Na2O2(过氧化钠)的装置,它的作用是与人呼出的二氧化碳反应生成氧气。于是他...
- (10成都18)木炭作为还原剂用于金属冶炼已有几千年历史。教材用如图I实验介绍这一知识。(1)木炭与氧化铜反应的化学方程式是_...
- (2009•常州)大龙在公园看到绿化工人往树干上涂抹具有杀菌杀虫作用的悬浊液,对其成份产生了好奇,于是他带回了一些样本进行...
- 化学是一门以实验为基础的科学,具备基本的化学实验技能是学习化学和进行化学探究活动的基础和保证.根据上图回答以下问题:...
- 确定气体的实验室制法,不需要考虑的是( )A.反应所需的药品和反应的条件B.实验装置C.反应速度及安全性D.气体的用途
- 市场上出售的纯净水中,有些是蒸馏水.对于这一类纯净水的下列说法,正确的是( )A.它的沸点是0℃B.它含有人类所需的多种矿...
- 化学变化的基本特征是[ ]A.发光放热B.生成新物质C.产生沉淀D.生成气体
- 在下列乐平工业生产中涉及化学变化的是( )A.煤矿开采煤B.石灰厂用石灰石烧制生石灰C.煤球厂用煤和红泥制土煤球D.木板厂...
- 下列变化属于化学变化的是( )A.瓷碗破碎B.红磷燃烧C.石蜡熔化D.铜丝弯曲
- 请从化学的视角进行分析,下列食品、调味品的制作过程中,没有发生化学变化的是[ ]A.鲜奶制酸奶B.水果榨果汁C.高粱酿白酒D.黄...