本试题 “认真对实验现象进行观察和分析,有助于获得化学知识并学会简单的科学探究方法。下列结论是对实验现象分析得出的。其中正确的是[ ]A. 某固体物质加到水中,液...” 主要考查您对化肥
生石灰的性质和用途
二氧化碳的检验和验满
离子的检验
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 化肥
- 生石灰的性质和用途
- 二氧化碳的检验和验满
- 离子的检验
化学肥料的概念:
化学肥料是指以矿物、空气、水做原料,经过化学加工制成含有植物生长所需的营养元素的物质,简称化肥。农作物所必需的营养元素有碳、氢、氧、氮、磷、钾、钙、镁等,其中氮、磷、钾需要量较大,因此氮肥、磷肥、钾肥是最主要的化学肥料。另外还有同时含有两种或两种以上营养元素的复合肥,植物生长过程中需要量比较少的微量元素肥料。
常见化学肥料:
1、氮肥
①作用:氮是合成蛋白质、核酸和叶绿素的重要元素,氮肥充足会使植物枝繁叶茂、果实硕大。缺少氮元素,会使植物生长发育迟缓或停滞,光合作用减慢等。外观表现为植株矮小,瘦弱,叶片发黄,严重时叶脉为棕色。
②氮肥的特性
a.氮盐与碱混合受热可产生一种无色、有刺激性气味的气体,它能使湿润的红色石蕊试纸变蓝。例如: NaOH+NH4NO3=NaNO3+H2O+NH3↑
检验按根离子(NH4+)时,需有可溶性碱和红色石蕊试纸。
b.氨水是氨气的水溶液,溶于水的氨气大部分与水反应生成一水合氨。一水合氨在水中发生电离,生成铵根离子和氢氧根离子。由于氨水中存在的阴离子全部是OH-,所以氨水呈碱性,一水合氨属于碱类。请注意,通常情况下氨水指氨气溶于水后生成的一水合氨(NH3·H2O),切勿将氨水的化学式写成NH4OH,因为氨水中没有NH4OH存在。
c.碳酸氢按受热分解:NH4HCO3==NH3↑+ CO2↑+H2O↑。
③氮的固定将氮气转化为氮的化合物的方法。如:豆科植物根部的根瘤菌能把空气中的氮气转化为含氮化合物,这类植物无需或只需少量使用氮肥。
2、磷肥
①作用:磷能促进作物生长,增强抗寒、抗旱能力。若缺乏磷元素,常表现为生长迟缓、产量降低,但磷过量则会引起作物贪青晚熟,结实率下降。外观表现为植株特别矮小,叶片出现紫色。
②常见磷肥有磷矿粉[Ca3(PO4)2]、钙镁磷肥(钙和镁的磷酸盐)、过磷酸钙[磷酸二氢钙Ca(H2PO4)2 和CaSO4的混合物]等。
3、钾肥
①作用:钾肥能保证各种代谢过程的顺利进行、促进植物生民、增强抗病虫害和抗倒伏能力。若缺乏钾元素,常表现为茎秆软弱、容易倒伏、叶片的边缘和尖端呈褐色,并逐渐焦枯。
②常见钾肥有硫酸钾(K2SO4)、氯化钾(KCl)和草木灰(主要成分为K2CO3)等。
(4)复合肥
含两种或两种以土营养元素的化肥。
①特点能同时均匀地供给作物几种养分,充分发挥营养元素间的互补作用,有效成分高。
②种类磷酸按〔磷酸二氢铵NH4H2PO4和磷酸氢二按 (NH4)2HPO4的混合物」、硝酸钾(KNO3)。
常见氮肥及性质:
化肥和农家肥的比较:
使用化肥、农药的利与弊:
①利:化肥、农药对提高农作物的产量具有重要的作用。
②弊:
a.不合理施用化肥会带来很多环境问题,一方面化肥中含有一些重金属元素、有毒有机物和放射性物质,施人后会引起潜在的土壤污染;另一方面化肥在施用过程中,因某些成分的积累、流失或变化,引起土壤酸化,水域中氮和磷含量升高,氮化物和硫化物气体排放等,造成土壤退化和水、大气环境的污染。
b.农药本身有毒,在杀灭病虫害的同时也带来了对自然环境的污染和对人体健康的危害。
使用化肥的注意事项:
①铰态氮肥不能与碱性物质(如碱、草木灰等)一起使用,因为铵态氮肥中的NH4+遇到OH-会生成易挥发的NH3,降低肥效。
②使用氨水或磷酸氢铵时要防止挥发,立即灌溉或用土盖上,人要站在上风口,因氨气对人的眼、鼻等膜有刺激作用。
③硝酸按受热易分解,在高温或猛烈撞击时易发生爆炸。所以当硝酸铵受潮结块时,不要用铁锤砸碎。
④硫酸按不易长时间使用,以免造成土壤酸性增强或土壤板结。
化肥鉴别的方法:
①一看、二闻、三溶看外观,氮肥、钾肥为白色晶体,磷肥是灰白色粉末;闻气味,碳酸氢按有强烈的氨味,可直接将它与其他氮肥相区别;加水溶解,氮肥、钾肥全部溶于水,磷肥大多不溶于水。铵盐的鉴别:(NH4)2SO4、NH4NO3等和熟石灰混合研磨,放出具有刺激性气味的氨气。
②氮肥的简易鉴别氮肥中的氨水呈液态,碳酸氧钱有强烈的氨味,据此可直接将它们与其他氮肥相区别。其他常见氮肥可按下列步骤鉴别:
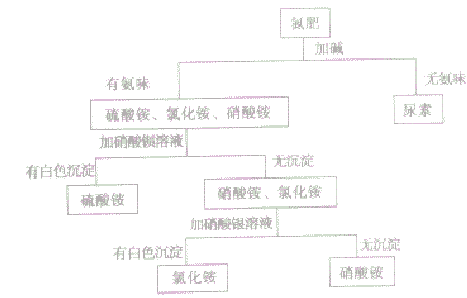
注意硫酸铵、氯化铵、硝酸铵同时鉴别时,不能先加硝酸银溶液鉴别氯化铵,因为硝酸银与硫酸铵反应,可能生成微溶物硫酸银,也可能出现沉淀。所以要区分含SO42-、Cl-和NO3-的三种物质时,一般是先加硝酸钡来鉴别出含有SO42-的物质,再加入硝酸银,鉴别出含有Cl-的物质,无现象的则是含有NO3-的物质。
③化肥鉴别歌鉴别化肥简易行,无锈铁片火烧红;化肥分别铁上放,各自现象皆不同;遇铁冒烟化成水,定是尿素不可疑;若是只熔不冒烟,刺鼻气味是磷铵;一阵烟后冒火星,必是硝铵显神通;铁上发出紫火焰,吱吱微响是硫铵;要想测知氯化铵,触铁味如浓盐酸;磷肥多为灰白色,置于红铁味难闻;放于红铁爆噼啪,无氨味者硫酸钾,氨化磷肥与有别,无烟臭气呛煞人;上述现象若不符,其中有诈须谨慎;认真鉴别把握准,防止上当把钱费。
盐的命名:
(1)只有两种元素组成的盐,读作“某化某”,如 NaCl读作氯化钠,AgI读作碘化银。
(2)构成中含有酸根的,读作“某酸某”。如Na2CO3、ZnSO4、AgNO3、KMnO4、KClO3分别读作:碳酸钠、硫酸锌、硝酸银、高锰酸钾、氯酸钾。
(3)含铵根的化合物,读作“某化铵”或“某酸铵”。如NH4Cl、(NH4)2SO4读作:氯化铵、硫酸铵。
(4)其他:Cu2(OH)2CO3读作“碱式碳酸铜”, NaHSO4读作“硫酸氢钠”, NaHCO3读作“碳酸氢钠”。
化学肥料是指以矿物、空气、水做原料,经过化学加工制成含有植物生长所需的营养元素的物质,简称化肥。农作物所必需的营养元素有碳、氢、氧、氮、磷、钾、钙、镁等,其中氮、磷、钾需要量较大,因此氮肥、磷肥、钾肥是最主要的化学肥料。另外还有同时含有两种或两种以上营养元素的复合肥,植物生长过程中需要量比较少的微量元素肥料。
常见化学肥料:
1、氮肥
①作用:氮是合成蛋白质、核酸和叶绿素的重要元素,氮肥充足会使植物枝繁叶茂、果实硕大。缺少氮元素,会使植物生长发育迟缓或停滞,光合作用减慢等。外观表现为植株矮小,瘦弱,叶片发黄,严重时叶脉为棕色。
②氮肥的特性
a.氮盐与碱混合受热可产生一种无色、有刺激性气味的气体,它能使湿润的红色石蕊试纸变蓝。例如: NaOH+NH4NO3=NaNO3+H2O+NH3↑
检验按根离子(NH4+)时,需有可溶性碱和红色石蕊试纸。
b.氨水是氨气的水溶液,溶于水的氨气大部分与水反应生成一水合氨。一水合氨在水中发生电离,生成铵根离子和氢氧根离子。由于氨水中存在的阴离子全部是OH-,所以氨水呈碱性,一水合氨属于碱类。请注意,通常情况下氨水指氨气溶于水后生成的一水合氨(NH3·H2O),切勿将氨水的化学式写成NH4OH,因为氨水中没有NH4OH存在。
c.碳酸氢按受热分解:NH4HCO3==NH3↑+ CO2↑+H2O↑。
③氮的固定将氮气转化为氮的化合物的方法。如:豆科植物根部的根瘤菌能把空气中的氮气转化为含氮化合物,这类植物无需或只需少量使用氮肥。
2、磷肥
①作用:磷能促进作物生长,增强抗寒、抗旱能力。若缺乏磷元素,常表现为生长迟缓、产量降低,但磷过量则会引起作物贪青晚熟,结实率下降。外观表现为植株特别矮小,叶片出现紫色。
②常见磷肥有磷矿粉[Ca3(PO4)2]、钙镁磷肥(钙和镁的磷酸盐)、过磷酸钙[磷酸二氢钙Ca(H2PO4)2 和CaSO4的混合物]等。
3、钾肥
①作用:钾肥能保证各种代谢过程的顺利进行、促进植物生民、增强抗病虫害和抗倒伏能力。若缺乏钾元素,常表现为茎秆软弱、容易倒伏、叶片的边缘和尖端呈褐色,并逐渐焦枯。
②常见钾肥有硫酸钾(K2SO4)、氯化钾(KCl)和草木灰(主要成分为K2CO3)等。
(4)复合肥
含两种或两种以土营养元素的化肥。
①特点能同时均匀地供给作物几种养分,充分发挥营养元素间的互补作用,有效成分高。
②种类磷酸按〔磷酸二氢铵NH4H2PO4和磷酸氢二按 (NH4)2HPO4的混合物」、硝酸钾(KNO3)。
常见氮肥及性质:
| 名称 | 化学式 | 性质 | 注意事项 |
| 尿素 | CO(NH2)2 | 白色或淡黄色晶体,易溶 于水,含氮量不超过46.7%, 肥效高且持久,对土壤无 不良影响 |
—— |
| 碳酸氢铵 | NH4HCO3 | 白色晶体,易溶于水,受潮 时常温下就能分解,温度越 高,分解越快,在土壤中不 残留有害杂质,含氮量低于 17.7% |
防分解,贮存和运输时 都要密封.不要受潮或暴 晒,施肥后掩盖或立即 灌溉,不要与碱性物质 混合使用 |
| 硝酸铵 | NH4NO3 | 白色晶体,易溶于水,高温 或受猛烈撞击时易爆炸,含 氮量低于35%,对土壤无不 良影响 |
不要与易燃物质或碱性 物质混合在一起,结块 时,不要用铁锤砸碎 |
| 硫酸铵 | (NH4)2SO4 | 白色固体,易溶于水,常温 下性质稳定,不宜长期大量 使用,否则会使土壤酸化、 板结硬化 |
不能与碱性物质混合, 不宜长期大量使用 |
| 氨水 | NH3·H2O | 氨气的水溶液,易挥发,显碱性 | 运愉、扩存、使用时要 防挥发 |
化肥和农家肥的比较:
| 所含元素种类少,但营养元素含量大 | 常含有多种营养元素,但营养元素含量较少 |
| 一般易溶于水,易被农作物吸收,肥效较快 | 一般较难溶于水,经腐熟后逐步转化为可溶于水、能被作物吸收的物质,肥效慢但肥期较长 |
| 便于工业生产,成本较高 | 便于就地取材,成本低廉 |
| 长期使用会破坏土壤的结构,使果蔬、谷物含有超量化肥,影响人体健康;化肥还会造成水体污染,引起水体富营养化 | 能改良土壤结构 |
使用化肥、农药的利与弊:
①利:化肥、农药对提高农作物的产量具有重要的作用。
②弊:
a.不合理施用化肥会带来很多环境问题,一方面化肥中含有一些重金属元素、有毒有机物和放射性物质,施人后会引起潜在的土壤污染;另一方面化肥在施用过程中,因某些成分的积累、流失或变化,引起土壤酸化,水域中氮和磷含量升高,氮化物和硫化物气体排放等,造成土壤退化和水、大气环境的污染。
b.农药本身有毒,在杀灭病虫害的同时也带来了对自然环境的污染和对人体健康的危害。
使用化肥的注意事项:
①铰态氮肥不能与碱性物质(如碱、草木灰等)一起使用,因为铵态氮肥中的NH4+遇到OH-会生成易挥发的NH3,降低肥效。
②使用氨水或磷酸氢铵时要防止挥发,立即灌溉或用土盖上,人要站在上风口,因氨气对人的眼、鼻等膜有刺激作用。
③硝酸按受热易分解,在高温或猛烈撞击时易发生爆炸。所以当硝酸铵受潮结块时,不要用铁锤砸碎。
④硫酸按不易长时间使用,以免造成土壤酸性增强或土壤板结。
化肥鉴别的方法:
①一看、二闻、三溶看外观,氮肥、钾肥为白色晶体,磷肥是灰白色粉末;闻气味,碳酸氢按有强烈的氨味,可直接将它与其他氮肥相区别;加水溶解,氮肥、钾肥全部溶于水,磷肥大多不溶于水。铵盐的鉴别:(NH4)2SO4、NH4NO3等和熟石灰混合研磨,放出具有刺激性气味的氨气。
②氮肥的简易鉴别氮肥中的氨水呈液态,碳酸氧钱有强烈的氨味,据此可直接将它们与其他氮肥相区别。其他常见氮肥可按下列步骤鉴别:

注意硫酸铵、氯化铵、硝酸铵同时鉴别时,不能先加硝酸银溶液鉴别氯化铵,因为硝酸银与硫酸铵反应,可能生成微溶物硫酸银,也可能出现沉淀。所以要区分含SO42-、Cl-和NO3-的三种物质时,一般是先加硝酸钡来鉴别出含有SO42-的物质,再加入硝酸银,鉴别出含有Cl-的物质,无现象的则是含有NO3-的物质。
③化肥鉴别歌鉴别化肥简易行,无锈铁片火烧红;化肥分别铁上放,各自现象皆不同;遇铁冒烟化成水,定是尿素不可疑;若是只熔不冒烟,刺鼻气味是磷铵;一阵烟后冒火星,必是硝铵显神通;铁上发出紫火焰,吱吱微响是硫铵;要想测知氯化铵,触铁味如浓盐酸;磷肥多为灰白色,置于红铁味难闻;放于红铁爆噼啪,无氨味者硫酸钾,氨化磷肥与有别,无烟臭气呛煞人;上述现象若不符,其中有诈须谨慎;认真鉴别把握准,防止上当把钱费。
盐的命名:
(1)只有两种元素组成的盐,读作“某化某”,如 NaCl读作氯化钠,AgI读作碘化银。
(2)构成中含有酸根的,读作“某酸某”。如Na2CO3、ZnSO4、AgNO3、KMnO4、KClO3分别读作:碳酸钠、硫酸锌、硝酸银、高锰酸钾、氯酸钾。
(3)含铵根的化合物,读作“某化铵”或“某酸铵”。如NH4Cl、(NH4)2SO4读作:氯化铵、硫酸铵。
(4)其他:Cu2(OH)2CO3读作“碱式碳酸铜”, NaHSO4读作“硫酸氢钠”, NaHCO3读作“碳酸氢钠”。
生石灰:
凡是以碳酸钙为主要成分的天然岩石,如石灰岩、白垩、白云质石灰岩等,都可用来生产石灰。 主要成分:氧化钙(CaO)。
物理性质:
一般呈块状,纯的为白色,含有杂质时为淡灰色或淡黄色。
化学性质:
在空气中吸收水和二氧化碳。氧化钙与水作用生成氢氧化钙,并放出热量。化学反应方程式为:CaO+H2O==Ca(OH)2
产品用途
1.可作填充剂,例如:用作环氧胶黏剂的填充剂;
2.用作分析试剂,气体分析时用作二氧化碳吸收剂,光谱分析试剂,高纯试剂用于半导体生产中的外延、扩散工序,实验室氨气的干燥及醇类脱l水等;
3.用作原料,可制造电石、纯碱、漂白粉等,也用于制革、废水净化,氢氧化钙及各种钙化合物;
4.可用作建筑材料、冶金助熔剂,水泥速凝剂,荧光粉的助熔剂。
5.用作植物油脱色剂,药物载体,土壤改良剂和钙肥;
6.还可用于耐火材料、干燥剂;
7.可配制农机1、2号胶和水下环氧胶黏剂,还用作与2402树脂预反应的反应剂;
8.用于酸性废水处理及污泥调质;
9.还可用作锅炉停用保护剂,利用石灰的吸湿能力,使锅炉水汽系统的金属表面保持干燥,防止腐蚀,适用于低压、中压、小容量汽包锅炉的长期停用保护;
注意事项:
1、使用操作过程时间越短越好,放置在包装容器内的适当处,起到密封吸湿的作用。
2、存放在干燥库房中,防潮,避免与酸类物接触。
3、运输过程中避免受潮,小心轻放,以防止包装破损而影响产品质量。
4、禁止食用,万一入口,用水漱口立即求医。(切记不能饮水,生石灰是碱性氧化物遇水会腐蚀!)
与熟石灰,石灰乳的区别:
1. 与熟石灰
①石灰有生石灰和熟石灰之分。生石灰的主要成分是氧化钙(CaO),白色固体耐火难溶。将(CaO)含量高的石灰岩在通风的石灰窑中锻烧至900℃以上即得。是有吸水性,可用作干燥剂,我国民间常用以防止杂物回潮。与水反应(同时放出大量的热),或吸收潮湿空气中的水分,即成熟石灰[氢氧化钙Ca(OH)2,又称“消石灰”。熟石灰在一升水中溶解1.56克(20℃),它的饱和溶液称为“石灰水”,呈碱性,在空气中吸收二氧化碳而成碳酸钙沉淀。
②与熟石灰的转化与硬化
生石灰(CaO)与水反应生成氢氧化钙的过程,称为石灰的熟化或消化。反应生成的产物氢氧化钙称为熟石灰或消石灰。
石灰熟化时放出大量的热,体积增大1—2.0倍。煅烧良好、氧化钙含量高的石灰熟化较快,放热量和体积增大也较多。工地上熟化石灰常用两种方法:消石灰浆法和消石灰粉法。
生石灰熟化后形成的石灰浆中,石灰粒子形成氢氧化钙胶体结构,颗粒极细(粒径约为1μm),比表面积很大(达10~30m2/g),其表面吸附一层较厚的水膜,可吸附大量的水,因而有较强保持水分的能力,即保水性好。将它掺入水泥砂浆中,配成混合砂浆,可显著提高砂浆的和易性。
石灰依靠干燥结晶以及碳化作用而硬化,由于空气中的二氧化碳含量低,且碳化后形成的碳酸钙硬壳阻止二氧化碳向内部渗透,也妨碍水分向外蒸发,因而硬化缓慢,硬化后的强度也不高,1:3的石灰砂浆28d的抗压强度只有0.2~0.5MPa。在处于潮湿环境时,石灰中的水分不蒸发,二氧化碳也无法渗入,硬化将停止;加上氢氧化钙微溶于水,已硬化的石灰遇水还会溶解溃散。因此,石灰不宜在长期潮湿和受水浸泡的环境中使用。
石灰在硬化过程中,要蒸发掉大量的水分,引起体积显著收缩,易出现干缩裂缝。所以,石灰不宜单独使用,一般要掺人砂、纸筋、麻刀等材料,以减少收缩,增加抗拉强度,并能节约石灰。 石灰具有较强的碱性,在常温下,能与玻璃态的活性氧化硅或活性氧化铝反应,生成有水硬性的产物,产生胶结。因此,石灰还是建筑材料工业中重要的原材料。
2. 与石灰乳
石灰乳一般是在氧化钙中加水生成的,因为氢氧化钙溶解度不是很大,所以往往生成的是氢氧化钙的悬浊液(即水溶液中还存在着没有溶解的氢氧化钙),这就是石灰乳
石灰乳是石灰浆用水稀释后的混浊液。 指石灰加入过量的水(约为石灰质量的2.5-3倍)后得到的浆体。
凡是以碳酸钙为主要成分的天然岩石,如石灰岩、白垩、白云质石灰岩等,都可用来生产石灰。 主要成分:氧化钙(CaO)。
物理性质:
一般呈块状,纯的为白色,含有杂质时为淡灰色或淡黄色。
化学性质:
在空气中吸收水和二氧化碳。氧化钙与水作用生成氢氧化钙,并放出热量。化学反应方程式为:CaO+H2O==Ca(OH)2
产品用途
1.可作填充剂,例如:用作环氧胶黏剂的填充剂;
2.用作分析试剂,气体分析时用作二氧化碳吸收剂,光谱分析试剂,高纯试剂用于半导体生产中的外延、扩散工序,实验室氨气的干燥及醇类脱l水等;
3.用作原料,可制造电石、纯碱、漂白粉等,也用于制革、废水净化,氢氧化钙及各种钙化合物;
4.可用作建筑材料、冶金助熔剂,水泥速凝剂,荧光粉的助熔剂。
5.用作植物油脱色剂,药物载体,土壤改良剂和钙肥;
6.还可用于耐火材料、干燥剂;
7.可配制农机1、2号胶和水下环氧胶黏剂,还用作与2402树脂预反应的反应剂;
8.用于酸性废水处理及污泥调质;
9.还可用作锅炉停用保护剂,利用石灰的吸湿能力,使锅炉水汽系统的金属表面保持干燥,防止腐蚀,适用于低压、中压、小容量汽包锅炉的长期停用保护;
注意事项:
1、使用操作过程时间越短越好,放置在包装容器内的适当处,起到密封吸湿的作用。
2、存放在干燥库房中,防潮,避免与酸类物接触。
3、运输过程中避免受潮,小心轻放,以防止包装破损而影响产品质量。
4、禁止食用,万一入口,用水漱口立即求医。(切记不能饮水,生石灰是碱性氧化物遇水会腐蚀!)
与熟石灰,石灰乳的区别:
1. 与熟石灰
①石灰有生石灰和熟石灰之分。生石灰的主要成分是氧化钙(CaO),白色固体耐火难溶。将(CaO)含量高的石灰岩在通风的石灰窑中锻烧至900℃以上即得。是有吸水性,可用作干燥剂,我国民间常用以防止杂物回潮。与水反应(同时放出大量的热),或吸收潮湿空气中的水分,即成熟石灰[氢氧化钙Ca(OH)2,又称“消石灰”。熟石灰在一升水中溶解1.56克(20℃),它的饱和溶液称为“石灰水”,呈碱性,在空气中吸收二氧化碳而成碳酸钙沉淀。
②与熟石灰的转化与硬化
生石灰(CaO)与水反应生成氢氧化钙的过程,称为石灰的熟化或消化。反应生成的产物氢氧化钙称为熟石灰或消石灰。
石灰熟化时放出大量的热,体积增大1—2.0倍。煅烧良好、氧化钙含量高的石灰熟化较快,放热量和体积增大也较多。工地上熟化石灰常用两种方法:消石灰浆法和消石灰粉法。
生石灰熟化后形成的石灰浆中,石灰粒子形成氢氧化钙胶体结构,颗粒极细(粒径约为1μm),比表面积很大(达10~30m2/g),其表面吸附一层较厚的水膜,可吸附大量的水,因而有较强保持水分的能力,即保水性好。将它掺入水泥砂浆中,配成混合砂浆,可显著提高砂浆的和易性。
石灰依靠干燥结晶以及碳化作用而硬化,由于空气中的二氧化碳含量低,且碳化后形成的碳酸钙硬壳阻止二氧化碳向内部渗透,也妨碍水分向外蒸发,因而硬化缓慢,硬化后的强度也不高,1:3的石灰砂浆28d的抗压强度只有0.2~0.5MPa。在处于潮湿环境时,石灰中的水分不蒸发,二氧化碳也无法渗入,硬化将停止;加上氢氧化钙微溶于水,已硬化的石灰遇水还会溶解溃散。因此,石灰不宜在长期潮湿和受水浸泡的环境中使用。
石灰在硬化过程中,要蒸发掉大量的水分,引起体积显著收缩,易出现干缩裂缝。所以,石灰不宜单独使用,一般要掺人砂、纸筋、麻刀等材料,以减少收缩,增加抗拉强度,并能节约石灰。 石灰具有较强的碱性,在常温下,能与玻璃态的活性氧化硅或活性氧化铝反应,生成有水硬性的产物,产生胶结。因此,石灰还是建筑材料工业中重要的原材料。
2. 与石灰乳
石灰乳一般是在氧化钙中加水生成的,因为氢氧化钙溶解度不是很大,所以往往生成的是氢氧化钙的悬浊液(即水溶液中还存在着没有溶解的氢氧化钙),这就是石灰乳
石灰乳是石灰浆用水稀释后的混浊液。 指石灰加入过量的水(约为石灰质量的2.5-3倍)后得到的浆体。
二氧化碳的检验和验满:
1.检验:用燃着的木条检验,如果木条熄灭,则证明有二氧化碳存在;
或用澄清石灰水检验,如果澄清石灰水变浑浊,则证明有二氧化碳存在

2.验满:将燃着的木条放在瓶口,若熄灭则证明二氧化碳已满
常见气体的检验:
1.检验:用燃着的木条检验,如果木条熄灭,则证明有二氧化碳存在;
或用澄清石灰水检验,如果澄清石灰水变浑浊,则证明有二氧化碳存在

2.验满:将燃着的木条放在瓶口,若熄灭则证明二氧化碳已满
常见气体的检验:
| 物质 | 检验试剂或方法或装置或步骤 | 反应现象 | 结论和化学式 |
| O2 | 带火星的木条 | 木条复燃 | 氧气能支持燃烧 |
| CO2 | 澄清石灰水 | 澄清石灰水变浑浊 | CO2+Ca(OH )2==CaCO3↓+H2O |
| CO | 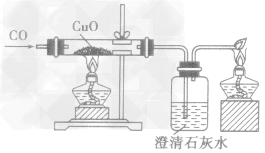 |
氧化铜由黑色变成红色,澄清石灰水变浑浊 | CO+CuO Cu+CO2 Cu+CO2Ca(OH)2+CO2==CaCO3↓+H2O |
| H2 |  |
氧化铜由黑色变成红色,无水CuSO4变成蓝色 | H2+CuO H2O+Cu H2O+CuCuSO4+5H2O==CuSO4·5H2O |
| H2O(g) |  |
无水CuSO4变蓝 | CuSO4+5H2O==CuSO4·5H2O |
| CH4 | (1)点燃 (2)火焰上方罩一个干燥的烧杯 (3)罩一个内壁用澄清石灰水润洗过的烧杯 |
(1)产生蓝色火焰 (2)烧杯内壁有水珠生成 (3)澄清石灰水变浑浊 |
CH4+O2 CO2+H2O CO2+H2OCa(OH)2+CO2==CaCO3↓+H2O |
| NH3 | (1)闻气味 (2)利用湿润的红色石蕊试纸检验 |
(1)有氨臭味 (2)湿润的红色石蕊试纸变蓝 |
—— |
定义:
判断溶液中阴阳离子的存在情况。
几种常见离子的检验
常见酸、碱、盐的检验:
检验中的干扰和排除
在物质的检验过程中,由于待检物质中混有杂质、选用试剂不当或试剂不纯,包括仪器不清净、操作有误等.都会对检验造成干扰,应当予以排除。如鉴定CO32- 和SO42-共存时,我们不应该选用硝酸银试剂,而应选用硝酸钡或氯化钡试剂。再如,当CO32-和SO42-共存时,我们要检验出SO42-,则应先加盐酸酸化,排除CO32-离了的干扰后,再用氯化钡试剂进行检验。
检验结果的分析和判断
根据检验过程中所观察到的观象确定试样中存在哪些离子,必须把可能存在的离子全部考虑到,再根据每步检验的现象,肯定或否定某些离子的存在,逐步缩小范围,最终得出正确的结论。
判断溶液中阴阳离子的存在情况。
几种常见离子的检验
| 离子 | 所用试剂 | 方法 | 现象 | 化学方程式 |
| Cl- | AgNO3溶液和稀HNO3 | 将AgNO3溶液滴入待测液中,再加稀HNO3 | 生成白色沉淀.且不溶于稀HNO3 | AgNO3+NaCl==AgCl↓+NaNO3 |
| SO42- | BaCl2溶液和稀盐酸 | 将稀盐酸滴入待测液中,再加BaCl2溶液 | 滴加稀盐酸无现象,滴加 BaCl2溶液生成白色沉淀,且沉淀不溶于稀盐酸 | BaCl2+Na2SO4==BaSO4↓+ +2NaCl |
| CO32- | 盐酸(或HNO3) 和澄清石灰水 | 向待测液中加入盐酸(或HNO3).将产生的气体通入澄清石灰水中 | 产生无色无味的气体,此气体能使澄清的石灰水变浑浊 | Na2CO3+2HCl==2NaCl+H2O+ CO2↑ CO2+Ca(OH)2==CaCO3↓+H2O |
| OH- | 酚酞试液、紫色石蕊试液或红色石蕊试纸 | ①将酚酞试液滴入待测液中 ②将紫色石蕊试液滴入待测液中 ③将待测液滴在红色石蕊试纸上 |
①溶液变红 ②溶液变蓝 ③红色石蕊试纸变蓝 |
—— |
| H+ | 紫色石蕊试液或蓝色石蕊试纸 | ①将紫色石蕊试液滴入待测液中 ②将待测液滴在蓝色石蕊试纸上 |
①溶液变红 ②蓝色石蕊试纸变红 |
—— |
| NH4+ | 浓NaOH溶液 | 将浓NaOH溶液加入待测液中,加热,将湿润的红色石蕊试纸置于试管口(或用玻璃棒蘸浓盐酸置于试管口) | 放出有刺激性气味的气体,该气体能使湿润的红色石蕊试纸变蓝(或遇到浓盐酸产生大量白烟) | NH4Cl+NaOH NaCl+H2O+NH3↑ NaCl+H2O+NH3↑ |
| Cu2+ | NaOH溶液 | 将NaOH溶液加入待测液中 | 生成蓝色沉淀 | CuSO4+2NaOH==Cu(OH)2↓ |
| Fe3+ | NaOH溶液 | 将NaOH溶液加入待测液中 | 生成蓝色沉淀 | FeCl3+3NaOH==Fe(OH)3↓+3NaCl |
常见酸、碱、盐的检验:
| 物质 | 检验方法 | 实验现象 | 典型化学式 |
| 硫酸及可溶性硫酸盐 | 取少量待检验溶液于试管中 (1)滴入紫色石蕊试液 (2)滴人稀盐酸和BaCl2溶液[或 Ba(NO3)2溶液] |
(1)溶液变红 (2)加入稀盐酸无明显现象,再加入BaCl2溶液有自色沉淀生成 |
H2SO4+BaCl2==BaSO4↓+2HCl Na2SO4+Ba(NO3)2==BaSO4↓+2NaNO3 |
| 盐酸及可溶性盐酸盐 | 取少量待检验溶液于试管中 (1)滴入紫色石蕊试液 (2)滴人AgNO3溶液和稀硝酸 |
(1)溶液变红 (2)有白色沉淀生成,且该沉淀不溶于稀硝酸 |
HCl+AgNO3=AgCl↓+HNO3 NaCl+AgNO3==AgCl↓+NaNO3 |
| 碳酸盐及碳酸氢盐 | 取少量待检验溶液于试管中 (1)加稀盐酸或稀硝酸 (2)将生成的气体通入澄清的石灰水中。 |
有气体生成,且该气体使澄清的石灰水变浑浊 | Na2CO3+2HCl=2NaCl+H2O+CO2↑ NaHCO3+HCl=NaCl+H2O+CO2↑ |
| 铵盐 | 将铵盐与碱混合共热 | 有刺激性气味气体生成 | NH4Cl+NaOH NaCl+NH3↑+H2O NaCl+NH3↑+H2O |
检验中的干扰和排除
在物质的检验过程中,由于待检物质中混有杂质、选用试剂不当或试剂不纯,包括仪器不清净、操作有误等.都会对检验造成干扰,应当予以排除。如鉴定CO32- 和SO42-共存时,我们不应该选用硝酸银试剂,而应选用硝酸钡或氯化钡试剂。再如,当CO32-和SO42-共存时,我们要检验出SO42-,则应先加盐酸酸化,排除CO32-离了的干扰后,再用氯化钡试剂进行检验。
检验结果的分析和判断
根据检验过程中所观察到的观象确定试样中存在哪些离子,必须把可能存在的离子全部考虑到,再根据每步检验的现象,肯定或否定某些离子的存在,逐步缩小范围,最终得出正确的结论。
发现相似题
与“认真对实验现象进行观察和分析,有助于获得化学知识并学会简...”考查相似的试题有:
- 化学与生活密切相关,下列相关叙述中正确的是[ ]A.人体体液的pH必须维持在一定范围内,pH过大会造成“碱中毒”B.食品添加剂都...
- 进行化学实验,观测实验现象,通过分析推理得出正确结论是化学学习的方法之一。对下列实验事实的解释正确的是[ ]A.高锰酸钾...
- 某混合溶液中有Na2SO4、NaCl和Na2CO3三种物质,若用AgNO3、BaCl2、盐酸三种试剂将混合溶液中的Cl﹣、SO42﹣、CO32﹣逐一完全...
- 请根据题意回答下列问题:(在下列2题中任选一题回答,若两小题都回答,则以第一小题的答案评定分数)(1)人被蚂蚁蛰伤,常...
- 物质的有关用途:①人工降雨;②制肥皂和造纸;③作电极;④建筑材料;⑤改良酸性土壤;⑥做馒头时,除去面团发酵生成的酸;⑦金属除...
- 生活中,下列溶液的pH>7的是A.汽水B.自来水C.肥皂水D.食醋
- 在托盘天平的两托盘上各放一只烧杯,分别注人足量的稀盐酸,天平平衡。向左边烧杯中加入10克金属锌,向右边烧杯中加入10克金...
- 下列实验方案或措施不合理的是A.用稀盐酸清除铁制品表面的铁锈B.用紫色石蕊鉴别稀盐酸和稀硫酸C.用CO2鉴别NaOH和Ca(OH)2溶...
- 以下物质:①金刚石 ②石油 ③氮气 ④生石灰 ⑤干冰 ⑥大理石.可用于人工降雨的是______;(填序号,下同);可用作保护气的是____...
- 下列有关气体的制取装置或实验操作,错误的是[ ]A.制取氧气的发生装置B.收集氧气C.检验二氧化碳是否收集满D.验证二氧化碳的水...