本试题 “配平下列方程式并指出反应类型.Na2O+H2O------NaOHAl+HCl------AlCl3+H2↑C+Fe2O3------Fe+CO2↑C3H8+O2------CO2+H2OCu2(OH)2CO3-----CuO+H2O+CO2↑” 主要考查您对氧化反应
分解反应
化合反应
置换反应
化学反应方程式的配平
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 氧化反应
- 分解反应
- 化合反应
- 置换反应
- 化学反应方程式的配平
定义:
氧化反应:物质与氧发生的化学反应,如S+O2 SO2;H2+CuO
SO2;H2+CuO H2O+Cu.
H2O+Cu.
氧化反应与缓慢氧化:
氧化反应:物质与氧发生的化学反应,如S+O2
 SO2;H2+CuO
SO2;H2+CuO H2O+Cu.
H2O+Cu.氧化反应与缓慢氧化:
| 氧化反应 | 缓慢氧化 | |
| 概念 | 物质与氧(包括氧气)发生的化学反应 | 物质与氧气发生的缓慢的,不易察觉的氧化反应 |
| 举例 | 所有与氧气发生的反应 | 铁生锈,食物腐烂 |
| 联系 | 氧化反应包括剧烈氧化和缓慢氧化两种 | |
| 相同点 | ①都是氧化反应②都放出热量 | |
概念:
由一种物质生成两种或两种以上物质的反应
特征:
一变多
表达式:
A = B + C
初中常见的分解反应:
按产物种类多少分类:
一、加热分解的产物有两种
1.分解成两种单质
⑴气态氢化物的分解
碘化氢的分解2HI=H2↑+I2
⑵氯化银的分解
氯化银的分解2AgCl=2Ag+Cl2↑
⑶电解
电解水2H2O 2H2↑+O2↑
2H2↑+O2↑
2.分解成两种化合物
⑴不稳定盐类的分解
碳酸钙的高温分解CaCO3 CaO+CO2↑
CaO+CO2↑
⑵不稳定弱碱的分解
氢氧化铝受热分解2Al(OH)3=Al2O3+3H2O
⑶不稳定弱酸的分解
碳酸的分解H2CO3=H2O+CO2↑
⑷含结晶水的盐类的脱水
十水碳酸钠的风化Na2CO3·10H2O=Na2CO3+10H2O
3.分解成一种单质和一种化合物
⑴不太稳定的盐类的分解
氯酸钾的催化分解2KClO3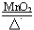 2KCl+3O2↑
2KCl+3O2↑
⑵不稳定酸的分解
次氯酸的分解2HClO=2HCl+O2
⑶双氧水的分解
受热(或以二氧化锰为催化剂)分解2H2O2=2H2O+O2
4.有机物的分解
甲烷的裂解2CH4=C2H2+3H2
二、加热分解的产物有三种
1.不稳定盐类的分解
⑴碳酸氢钠受热分解2NaHCO3=Na2CO3+CO2↑+H2O
⑵亚硫酸的酸式强碱盐受热分解
亚硫酸氢钠受热分解 2NaHSO3=Na2SO4+SO2↑+H2O
⑶铵盐的受热分解
碳酸铵受热分解
(NH4)2CO3=2NH3↑+H2O↑+CO2↑
⑷高锰酸钾受热分解
2KMnO4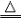 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
⑸硝酸盐的受热分解
硝酸银的受热分解2AgNO3=2Ag+2NO2↑+O2↑
2.硝酸的分解
4HNO3=4NO2+O2+2H2O
3.电解水溶液
⑴电解饱和食盐水
2NaCl+2H2O=2NaOH+H2↑+Cl2↑
按反应物种类进行分类:
1.酸的分解反应。
⑴含氧酸=非金属氧化物+水 如H2CO3=CO2↑+H2O,H2SO3=SO2↑+H2O
⑵某些含氧酸的分解比较特殊, 如
硝酸的分解: 4HNO3(浓)=4NO2↑+O2↑+2H2O,
次氯酸分解 2HClO=2HCl+O2↑
磷酸脱水 4H3PO4 (HPO3)4+4H2O↑ ;
(HPO3)4+4H2O↑ ;
2H3PO4 H4P2O7+H2O↑
H4P2O7+H2O↑
3H3PO4 H5P3O10+2H2O↑
H5P3O10+2H2O↑
2.碱的分解反应:
活泼金属的氢氧化物较难分解,难溶性碱一般都较易分解: 2Al(OH)3=Al2O3+3H2O, 2Fe(OH)3=Fe2O3+3H2O, Cu(OH)2=CuO十H2O。
3.盐的分解反应:
碳酸盐、硝酸盐、铵盐一般都较易分解,且反应表现出一定的规律性。
⑴碳酸盐的分解:
碳酸盐=金属氧化物十CO2↑ 如CaCO3 CaO+CO2↑,CuCO3
CaO+CO2↑,CuCO3 CuO+CO2↑
CuO+CO2↑
K2CO3、Na2CO3比较稳定,很难分解,而其酸式盐较易分解:
2NaHCO3=Na2CO3+CO2↑+H2O
Ca(HCO3)2=CaCO3+CO2↑+H2O
⑵硝酸盐的分解反应。硝酸盐受热均易分解,并放出氧气,其规律大体如下:
活动性强的金属(K、Ca、Na)硝酸盐=亚硝酸盐+O2↑:
如 2KNO3=2KNO2+O2↑。
处于活动性顺序表中间的金属(Mg、Cu等)的硝酸盐=金属氧化物+NO2↑+O2↑:
如2Mg(NO3)2=2MgO+4NO2↑+O2↑ 2Cu(NO3)2=2CuO+4NO2↑+O2↑
不活动金属(Hg、Ag、Au)的硝酸盐=金属+NO2↑+O2↑:
如 Hg(NO3)2=Hg+2NO2↑+O2↑; 2AgNO3=2Ag+2NO2↑+O2↑
⑶铵盐的分解反应。铵盐受热易分解,一般都有氨气放出:
如(NH4)2SO4=2NH3↑+H2SO4 ;NH4HCO3=NH3↑+CO2↑+H2O。
⑷其它盐类的分解反应
如 2KClO3=2KCl+3O2↑ 2KMnO4=K2MnO4+MnO2+O2↑
4.氧化物的分解反应:
非金属氧化物一般不容易发生分解反应 2H2O2=H2↑+O2↑
金属氧化物一般分解的规律是: 金属活动顺序表中,排在铜后的金属氧化物受热易分解:
如 2HgO=2Hg+O2↑,2Ag2O=4Ag+O2↑
活泼的金属氧化物,给它们熔化态通电流可使其分解:
如2Al2O3(熔化)=4Al+3O2↑
由一种物质生成两种或两种以上物质的反应
特征:
一变多
表达式:
A = B + C
初中常见的分解反应:
按产物种类多少分类:
一、加热分解的产物有两种
1.分解成两种单质
⑴气态氢化物的分解
碘化氢的分解2HI=H2↑+I2
⑵氯化银的分解
氯化银的分解2AgCl=2Ag+Cl2↑
⑶电解
电解水2H2O
 2H2↑+O2↑
2H2↑+O2↑2.分解成两种化合物
⑴不稳定盐类的分解
碳酸钙的高温分解CaCO3
 CaO+CO2↑
CaO+CO2↑ ⑵不稳定弱碱的分解
氢氧化铝受热分解2Al(OH)3=Al2O3+3H2O
⑶不稳定弱酸的分解
碳酸的分解H2CO3=H2O+CO2↑
⑷含结晶水的盐类的脱水
十水碳酸钠的风化Na2CO3·10H2O=Na2CO3+10H2O
3.分解成一种单质和一种化合物
⑴不太稳定的盐类的分解
氯酸钾的催化分解2KClO3
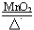 2KCl+3O2↑
2KCl+3O2↑⑵不稳定酸的分解
次氯酸的分解2HClO=2HCl+O2
⑶双氧水的分解
受热(或以二氧化锰为催化剂)分解2H2O2=2H2O+O2
4.有机物的分解
甲烷的裂解2CH4=C2H2+3H2
二、加热分解的产物有三种
1.不稳定盐类的分解
⑴碳酸氢钠受热分解2NaHCO3=Na2CO3+CO2↑+H2O
⑵亚硫酸的酸式强碱盐受热分解
亚硫酸氢钠受热分解 2NaHSO3=Na2SO4+SO2↑+H2O
⑶铵盐的受热分解
碳酸铵受热分解
(NH4)2CO3=2NH3↑+H2O↑+CO2↑
⑷高锰酸钾受热分解
2KMnO4
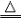 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑ ⑸硝酸盐的受热分解
硝酸银的受热分解2AgNO3=2Ag+2NO2↑+O2↑
2.硝酸的分解
4HNO3=4NO2+O2+2H2O
3.电解水溶液
⑴电解饱和食盐水
2NaCl+2H2O=2NaOH+H2↑+Cl2↑
按反应物种类进行分类:
1.酸的分解反应。
⑴含氧酸=非金属氧化物+水 如H2CO3=CO2↑+H2O,H2SO3=SO2↑+H2O
⑵某些含氧酸的分解比较特殊, 如
硝酸的分解: 4HNO3(浓)=4NO2↑+O2↑+2H2O,
次氯酸分解 2HClO=2HCl+O2↑
磷酸脱水 4H3PO4
 (HPO3)4+4H2O↑ ;
(HPO3)4+4H2O↑ ;2H3PO4
 H4P2O7+H2O↑
H4P2O7+H2O↑ 3H3PO4
 H5P3O10+2H2O↑
H5P3O10+2H2O↑ 2.碱的分解反应:
活泼金属的氢氧化物较难分解,难溶性碱一般都较易分解: 2Al(OH)3=Al2O3+3H2O, 2Fe(OH)3=Fe2O3+3H2O, Cu(OH)2=CuO十H2O。
3.盐的分解反应:
碳酸盐、硝酸盐、铵盐一般都较易分解,且反应表现出一定的规律性。
⑴碳酸盐的分解:
碳酸盐=金属氧化物十CO2↑ 如CaCO3
 CaO+CO2↑,CuCO3
CaO+CO2↑,CuCO3 CuO+CO2↑
CuO+CO2↑K2CO3、Na2CO3比较稳定,很难分解,而其酸式盐较易分解:
2NaHCO3=Na2CO3+CO2↑+H2O
Ca(HCO3)2=CaCO3+CO2↑+H2O
⑵硝酸盐的分解反应。硝酸盐受热均易分解,并放出氧气,其规律大体如下:
活动性强的金属(K、Ca、Na)硝酸盐=亚硝酸盐+O2↑:
如 2KNO3=2KNO2+O2↑。
处于活动性顺序表中间的金属(Mg、Cu等)的硝酸盐=金属氧化物+NO2↑+O2↑:
如2Mg(NO3)2=2MgO+4NO2↑+O2↑ 2Cu(NO3)2=2CuO+4NO2↑+O2↑
不活动金属(Hg、Ag、Au)的硝酸盐=金属+NO2↑+O2↑:
如 Hg(NO3)2=Hg+2NO2↑+O2↑; 2AgNO3=2Ag+2NO2↑+O2↑
⑶铵盐的分解反应。铵盐受热易分解,一般都有氨气放出:
如(NH4)2SO4=2NH3↑+H2SO4 ;NH4HCO3=NH3↑+CO2↑+H2O。
⑷其它盐类的分解反应
如 2KClO3=2KCl+3O2↑ 2KMnO4=K2MnO4+MnO2+O2↑
4.氧化物的分解反应:
非金属氧化物一般不容易发生分解反应 2H2O2=H2↑+O2↑
金属氧化物一般分解的规律是: 金属活动顺序表中,排在铜后的金属氧化物受热易分解:
如 2HgO=2Hg+O2↑,2Ag2O=4Ag+O2↑
活泼的金属氧化物,给它们熔化态通电流可使其分解:
如2Al2O3(熔化)=4Al+3O2↑
概念:指的是由两种或两种以上的物质生成一种新物质的反应。其中部分反应为氧化还原反应,部分为非氧化还原反应。 此外,化合反应一般释放出能量。
注意:不是所有的化合反应都是放热反应。
特征:多变一
表达式:a+b=ab
初中常见化合反应:
1.金属+氧气→金属氧化物
很多金属都能跟氧气直接化合。例如常见的金属铝接触空气,它的表面便能立即生成一层致密的氧化膜,可阻止内层铝继续被氧化。4Al+3O2=2Al2O3
2.非金属+氧气→非金属氧化物 经点燃,许多非金属都能在氧气里燃烧,如:C+O2 CO2
CO2
3.金属+非金属→无氧酸盐 许多金属能与非金属氯、硫等直接化合成无氧酸盐。如 2Na+Cl2 2NaCl
2NaCl
4.氢气+非金属→气态氢化物 因氢气性质比较稳定,反应一般需在点燃或加热条件下进行。如 2H2+O2 2H2O
2H2O
5.碱性氧化物+水→碱. 多数碱性氧化物不能跟水直接化合。判断某种碱性氧化物能否跟水直接化合,一般的方法是看对应碱的溶解性,对应的碱是可溶的或微溶的,则该碱性氧化物能与水直接化合。如: Na2O+H2O=2NaOH. 对应的碱是难溶的,则该碱性氧化物不能跟水直接化合。如CuO、Fe2O3都不能跟水直接化合。
6.酸性氧化物+水→含氧酸. 除SiO2外,大多数酸性氧化物能与水直接化合成含氧酸。如: CO2+H2O=H2CO3
7.碱性氧化物+酸性氧化物→含氧酸盐 Na2O+CO2=Na2CO3。大多数碱性氧化物和酸性氧化物可以进行这一反应。其碱性氧化物对应的碱碱性越强,酸性氧化物对应的酸酸性越强,反应越易进行。
8.氨+氯化氢→氯化铵 氨气易与氯化氢化合成氯化铵。如: NH3+HCl=NH4Cl
9.硫和氧气在点燃的情况下形成二氧化硫 S+O2 SO2
SO2
10.特殊化合反应
公式 A+B+…+N→X(有些化合反应属于燃烧反应)
例如:铁+氧气 四氧化三铁 3Fe+2O2
四氧化三铁 3Fe+2O2 Fe3O4
Fe3O4
注意:不是所有的化合反应都是放热反应。
特征:多变一
表达式:a+b=ab
初中常见化合反应:
1.金属+氧气→金属氧化物
很多金属都能跟氧气直接化合。例如常见的金属铝接触空气,它的表面便能立即生成一层致密的氧化膜,可阻止内层铝继续被氧化。4Al+3O2=2Al2O3
2.非金属+氧气→非金属氧化物 经点燃,许多非金属都能在氧气里燃烧,如:C+O2
 CO2
CO2 3.金属+非金属→无氧酸盐 许多金属能与非金属氯、硫等直接化合成无氧酸盐。如 2Na+Cl2
 2NaCl
2NaCl 4.氢气+非金属→气态氢化物 因氢气性质比较稳定,反应一般需在点燃或加热条件下进行。如 2H2+O2
 2H2O
2H2O 5.碱性氧化物+水→碱. 多数碱性氧化物不能跟水直接化合。判断某种碱性氧化物能否跟水直接化合,一般的方法是看对应碱的溶解性,对应的碱是可溶的或微溶的,则该碱性氧化物能与水直接化合。如: Na2O+H2O=2NaOH. 对应的碱是难溶的,则该碱性氧化物不能跟水直接化合。如CuO、Fe2O3都不能跟水直接化合。
6.酸性氧化物+水→含氧酸. 除SiO2外,大多数酸性氧化物能与水直接化合成含氧酸。如: CO2+H2O=H2CO3
7.碱性氧化物+酸性氧化物→含氧酸盐 Na2O+CO2=Na2CO3。大多数碱性氧化物和酸性氧化物可以进行这一反应。其碱性氧化物对应的碱碱性越强,酸性氧化物对应的酸酸性越强,反应越易进行。
8.氨+氯化氢→氯化铵 氨气易与氯化氢化合成氯化铵。如: NH3+HCl=NH4Cl
9.硫和氧气在点燃的情况下形成二氧化硫 S+O2
 SO2
SO210.特殊化合反应
公式 A+B+…+N→X(有些化合反应属于燃烧反应)
例如:铁+氧气
 四氧化三铁 3Fe+2O2
四氧化三铁 3Fe+2O2 Fe3O4
Fe3O4概念:由一种单质和一种化合物反应,生成另一种单质和另一种化合物的反应。
特征:单质+化合物→新单质+新化合物
表达式:A+BC=B+AC
置换反应的规律和发生条件:
特征:单质+化合物→新单质+新化合物
表达式:A+BC=B+AC
置换反应的规律和发生条件:
| 规律 | 发生条件 | 实例 |
| H2+金属氧化物→金属+水 | ①加热 ②K、Ca、Na、Mg、Al等的氧化物除外 |
H2+CuO Cu+H2O Cu+H2O3H2+Fe2O3 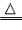 2Fe+3H2O 2Fe+3H2O |
| 碳+金属氧化物→金属+CO2 | ①高温 ②K、Ca、Na、Mg、Al等的氧化物除外 |
C+2CuO 2Cu+CO2↑ 2Cu+CO2↑3C+2Fe2O3  4Fe+3CO2↑ 4Fe+3CO2↑ |
| 金属+酸→盐+氢气 | ①浓硫酸,硝酸具有氧化性,和金属反应不生成氢气; ②在金属活动性顺序中排在氢前面的金属才能置换出酸中的氢 |
Zn+2HCl==ZnCl2+H2↑ Zn+H2SO4(稀)==ZnSO4+H2↑ 2Al+3H2SO4(稀)==Al2(SO4)3+3H2↑ |
| 金属+盐→新盐+新金属 | ①盐必须能溶于水 ②在金属活动性顺序表中,排在前面的金属才能置换出后面的金属 ③钾、钙、钠很活泼,与盐溶液反应不能置换出金属 |
Cu+Hg(NO3)2==Hg+Cu(NO3)2 Fe+CuSO4=FeSO4+Cu |
化学方程式的配平:
根据质量守恒定律,反应前后原子的种类和数目不变,在反应物和生成物的化学式前配上适当的化学计址数,使各种元素的原子个数在反应前后相等。
配平常用方法:
(1)最小公倍数法
①找出化学方程式左、右两边各出现一次,且原子个数既不相等又相对较多的元素,求出最小公倍数。
②用最小公倍数分别除以含有该元素的化学式中该元素的原子个数,其商就是化学式前的化学计量数。
③由已有的化学计量数,确定其他化学式的化学计量数。如配平:P+O2 P2O5,反应前有1个氧分子(即2个氧原子),反应后有5个氧原子,最小公倍数为2× 5=10,O2的化学计量数为10/2=5,P2O5的化学计量数为10/5=2,那么P的化学计量数为4,把短线改为等号:4P+5O2
P2O5,反应前有1个氧分子(即2个氧原子),反应后有5个氧原子,最小公倍数为2× 5=10,O2的化学计量数为10/2=5,P2O5的化学计量数为10/5=2,那么P的化学计量数为4,把短线改为等号:4P+5O2 2P2O5。
2P2O5。
(2)观察法:
如配平:CO+Fe2O3 Fe+CO2,观察发现此反应的1个特点是1个CO分子结合1个氧原子生成1个CO2分子,而Fe2O3中提供了3个氧原子,需要与3个CO分子结合生成3个CO2分子,因此CO,CO2前均配上化学计量数3,Fe的化学计量数为2,把短线改为等号:3CO+Fe2O3
Fe+CO2,观察发现此反应的1个特点是1个CO分子结合1个氧原子生成1个CO2分子,而Fe2O3中提供了3个氧原子,需要与3个CO分子结合生成3个CO2分子,因此CO,CO2前均配上化学计量数3,Fe的化学计量数为2,把短线改为等号:3CO+Fe2O3 2Fe+3CO2。
2Fe+3CO2。
(3)奇数配偶法
配平方法的要点:找出化学方程式两边出现次数最多而且在化学式中原子个数总是一奇一偶的元素,在原子个数是奇数的化学式前配上最小的偶数2,使原子个数由奇数变为偶数并加以配平,若2配不平,再换成4。如配平:FeS2+O2 Fe2O3+SO2。 氧元素是该化学方程式中出现次数最多的元素, Fe2O3中的氧原子个数为奇数(3个),先在Fe2O3前配化学计量数2,接着在FeS2前面配上化学计量数4,使两边的铁原子个数相等。4FeS2+O2
Fe2O3+SO2。 氧元素是该化学方程式中出现次数最多的元素, Fe2O3中的氧原子个数为奇数(3个),先在Fe2O3前配化学计量数2,接着在FeS2前面配上化学计量数4,使两边的铁原子个数相等。4FeS2+O2 2Fe2O3+SO2;再在SO2前面配上化学计战数8,使两边S原子个数相等,4FeS2+O2
2Fe2O3+SO2;再在SO2前面配上化学计战数8,使两边S原子个数相等,4FeS2+O2 2Fe2O3+8SO2;那么生成物各物质前的化学计量数都已确定,氧原子个数也确定,一共22 个,所以在O2前面必须加上化学计量数11才能使化学方程式配平,最后将短线改成等号,即4FeS2+11O2
2Fe2O3+8SO2;那么生成物各物质前的化学计量数都已确定,氧原子个数也确定,一共22 个,所以在O2前面必须加上化学计量数11才能使化学方程式配平,最后将短线改成等号,即4FeS2+11O2 2Fe2O3+8SO2。
2Fe2O3+8SO2。
(4)定一法
定一法又叫原子守恒法,它适用于配平较复杂的化学方程式,其配平步骤为:
①将式中最复杂的化学式的化学计量数定为1,作为配平起点;
②根据原子个数守恒确定其他物质的化学计量数 (可为分数);
③若配平后化学计量数出现分数,则在式子两边同乘其分母数,使化学计量数之比变成最简整数比。例如:配平CH3OH+O2 CO2+H2O。
CO2+H2O。
(5)待定系数法
C2H2+O2 CO2+H2O
CO2+H2O
设化学式前的化学计量数分别为a,b,c,d,
aC2H2+bO2==cCO2+H2O.
根据质量守恒定律有:
碳原子数:2a=c
氢原子数:2a=2d
氧原子数:2b=2c+d
解得a:b:c:d==2:5:4:2
化学方程式为2C2H2+5O2 4CO2+2H2O
4CO2+2H2O
配平步骤:
a.所给化学方程式中,化学式CH3OH最复杂,将其化学计量数定为1,作为配平起点;
b.通过观察,根据碳原子守恒,在CO2前配上化学计量数1,根据氢原子守恒,在H2O前配上化学计量数2,故生成物中含有氧原子数为1×2+2×1=4,而反应物CH3OH中有一个氧原子,故O2前化学计量数为(4一1)/3 =3/2
c.通分化整,将式子两边化学式前的化学计量数都同乘2,去掉O2前化学计量数的分母,化学方程式即配平。
配平结果:2CH3OH+3O2 2CO2+4H2O
2CO2+4H2O
根据质量守恒定律,反应前后原子的种类和数目不变,在反应物和生成物的化学式前配上适当的化学计址数,使各种元素的原子个数在反应前后相等。
配平常用方法:
(1)最小公倍数法
①找出化学方程式左、右两边各出现一次,且原子个数既不相等又相对较多的元素,求出最小公倍数。
②用最小公倍数分别除以含有该元素的化学式中该元素的原子个数,其商就是化学式前的化学计量数。
③由已有的化学计量数,确定其他化学式的化学计量数。如配平:P+O2
 P2O5,反应前有1个氧分子(即2个氧原子),反应后有5个氧原子,最小公倍数为2× 5=10,O2的化学计量数为10/2=5,P2O5的化学计量数为10/5=2,那么P的化学计量数为4,把短线改为等号:4P+5O2
P2O5,反应前有1个氧分子(即2个氧原子),反应后有5个氧原子,最小公倍数为2× 5=10,O2的化学计量数为10/2=5,P2O5的化学计量数为10/5=2,那么P的化学计量数为4,把短线改为等号:4P+5O2 2P2O5。
2P2O5。(2)观察法:
如配平:CO+Fe2O3
 Fe+CO2,观察发现此反应的1个特点是1个CO分子结合1个氧原子生成1个CO2分子,而Fe2O3中提供了3个氧原子,需要与3个CO分子结合生成3个CO2分子,因此CO,CO2前均配上化学计量数3,Fe的化学计量数为2,把短线改为等号:3CO+Fe2O3
Fe+CO2,观察发现此反应的1个特点是1个CO分子结合1个氧原子生成1个CO2分子,而Fe2O3中提供了3个氧原子,需要与3个CO分子结合生成3个CO2分子,因此CO,CO2前均配上化学计量数3,Fe的化学计量数为2,把短线改为等号:3CO+Fe2O3 2Fe+3CO2。
2Fe+3CO2。 (3)奇数配偶法
配平方法的要点:找出化学方程式两边出现次数最多而且在化学式中原子个数总是一奇一偶的元素,在原子个数是奇数的化学式前配上最小的偶数2,使原子个数由奇数变为偶数并加以配平,若2配不平,再换成4。如配平:FeS2+O2
 Fe2O3+SO2。 氧元素是该化学方程式中出现次数最多的元素, Fe2O3中的氧原子个数为奇数(3个),先在Fe2O3前配化学计量数2,接着在FeS2前面配上化学计量数4,使两边的铁原子个数相等。4FeS2+O2
Fe2O3+SO2。 氧元素是该化学方程式中出现次数最多的元素, Fe2O3中的氧原子个数为奇数(3个),先在Fe2O3前配化学计量数2,接着在FeS2前面配上化学计量数4,使两边的铁原子个数相等。4FeS2+O2 2Fe2O3+SO2;再在SO2前面配上化学计战数8,使两边S原子个数相等,4FeS2+O2
2Fe2O3+SO2;再在SO2前面配上化学计战数8,使两边S原子个数相等,4FeS2+O2 2Fe2O3+8SO2;那么生成物各物质前的化学计量数都已确定,氧原子个数也确定,一共22 个,所以在O2前面必须加上化学计量数11才能使化学方程式配平,最后将短线改成等号,即4FeS2+11O2
2Fe2O3+8SO2;那么生成物各物质前的化学计量数都已确定,氧原子个数也确定,一共22 个,所以在O2前面必须加上化学计量数11才能使化学方程式配平,最后将短线改成等号,即4FeS2+11O2 2Fe2O3+8SO2。
2Fe2O3+8SO2。 (4)定一法
定一法又叫原子守恒法,它适用于配平较复杂的化学方程式,其配平步骤为:
①将式中最复杂的化学式的化学计量数定为1,作为配平起点;
②根据原子个数守恒确定其他物质的化学计量数 (可为分数);
③若配平后化学计量数出现分数,则在式子两边同乘其分母数,使化学计量数之比变成最简整数比。例如:配平CH3OH+O2
 CO2+H2O。
CO2+H2O。 (5)待定系数法
C2H2+O2
 CO2+H2O
CO2+H2O 设化学式前的化学计量数分别为a,b,c,d,
aC2H2+bO2==cCO2+H2O.
根据质量守恒定律有:
碳原子数:2a=c
氢原子数:2a=2d
氧原子数:2b=2c+d
解得a:b:c:d==2:5:4:2
化学方程式为2C2H2+5O2
 4CO2+2H2O
4CO2+2H2O配平步骤:
a.所给化学方程式中,化学式CH3OH最复杂,将其化学计量数定为1,作为配平起点;
b.通过观察,根据碳原子守恒,在CO2前配上化学计量数1,根据氢原子守恒,在H2O前配上化学计量数2,故生成物中含有氧原子数为1×2+2×1=4,而反应物CH3OH中有一个氧原子,故O2前化学计量数为(4一1)/3 =3/2
c.通分化整,将式子两边化学式前的化学计量数都同乘2,去掉O2前化学计量数的分母,化学方程式即配平。
配平结果:2CH3OH+3O2
 2CO2+4H2O
2CO2+4H2O 发现相似题
与“配平下列方程式并指出反应类型.Na2O+H2O------NaOHAl+HCl---...”考查相似的试题有:
- 现有①木炭②硫磺③红磷④细铁丝⑤蜡烛,五种物质分别在氧气中燃烧,用序号回答下列问题:(1)发出明亮的蓝紫色火焰的是 .(2)...
- 下列说法错误的是( )A.化合反应一定要加热B.在复分解反应中,没有单质参与C.置换反应一定有新的单质生成D.中和反应一定...
- 写出下列反应的文字表达式并在括号中注明反应基本类型.(1)铁丝在氧气中燃烧火星四射 _________________________(2)实验...
- 钠原子结构示意图如右图所示。下列有关钠原子的说法不正确的是A.核外有3个电子层B.质子数为11C.最外层电子数为1D.在化学...
- “达菲”是目前世界上预防甲型H1N1流感的良方之一,近段时期,我国准备了大量的达菲作为应对甲型H1N1流感的储备用药,已知达菲...
- 用数轴表示某些化学知识直观、简明、易记,下列错误的是( )A.镁、锌、铜的金属活动性强弱:B.硫及其化合物与化合价的关系...
- 据《彭城晚报》报道:从2003年12月起,徐州市全面禁止销售含磷洗涤剂。含磷洗涤剂中的Na5PxO10会造成水的污染,该物质中磷元...
- 地壳中含量最多的元素是A.铝B.铁C.氧D.硅
- 化学方程式是学习化学的重要工具之一,根据化学方程式不能获得的信息是A.该反应中的反应物和生成物B.化学反应的快慢C.反应...
- 常温下,由分子构成、密度最小的气态物质是 ,用化学方程式表示出该物质的一个化学性质 ,写出该物质的一条用途 .