本试题 “在半导体生产或灭火剂的使用中,会向空气逸散气体如:NF3、CHClFCF3、C3F8,它们虽是微量的,有些确是强温室气体,下列推测不正确的是( ) A.熔点NF3>C3F8...” 主要考查您对溶解性
杂化轨道理论(中心原子杂化方式)
范德华力
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 溶解性
- 杂化轨道理论(中心原子杂化方式)
- 范德华力
溶解性:
(1)相似相溶原理:极性分子易溶于极性分子溶剂中(如HCl易溶于水中),非极性分子易溶于非极性分子溶剂中(如CO2易溶于CS2中)
(2)分子结构:含有相同官能团且该官能团在分子中所占比重较大的物质能够相互溶解。如:乙醇与水互溶;戊醇不能与水互溶、与己烷能互溶。
(3)分子之间能形成氢键,会增大溶解度。
(4)溶质若能与溶剂发生反应,溶解度会增大。
(1)相似相溶原理:极性分子易溶于极性分子溶剂中(如HCl易溶于水中),非极性分子易溶于非极性分子溶剂中(如CO2易溶于CS2中)
(2)分子结构:含有相同官能团且该官能团在分子中所占比重较大的物质能够相互溶解。如:乙醇与水互溶;戊醇不能与水互溶、与己烷能互溶。
(3)分子之间能形成氢键,会增大溶解度。
(4)溶质若能与溶剂发生反应,溶解度会增大。
影响物质溶解性的因素:
1.看溶质与水能否发生反应
溶质若能与水发生反应,则会增大溶质的溶解度,如
2.分子的极性
非极性分子构成的物质易溶于非极性溶剂,难溶于极性溶剂;极性分子构成的物质易溶于极性溶剂,难溶于非极性溶剂。如苯易溶于植物油而难溶于水; NH3、HCl易溶于水而难溶于苯。
3.氢键
溶质与溶剂分子之间若能形成分子问氢键,会增大溶质的溶解度。如NH3、HF都能与H2O形成分子间氢键,溶解度较大。
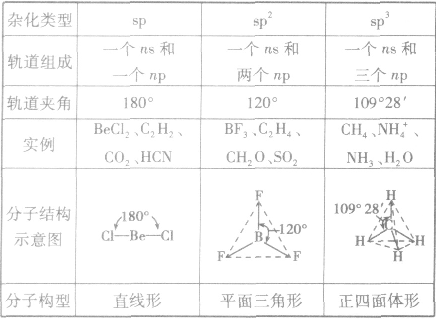
杂化轨道理论:
是鲍林为了解释分子的立体结构提出的。中心原子杂化轨道、孤电子对数及与之相连的原子数间的关系是:杂化轨道数=孤电子对数+与之相连的原子数。杂化前后轨道总数比变,杂化轨道用来形成σ键或容纳孤对电子,未杂化的轨道与杂化轨道所在平面垂直,可用来形成π键。
常见杂化方式:
(1)sp杂化:直线型 如:CO2、CS2
(2)sp2杂化:平面三角形(等性杂化为平面正三角形) 如:BCl3 C2H4
不等性杂化为V字型 如:H2O H2S OF2
(3)sp3杂化:空间四面体(等性杂化为正四面体) 如:CH4、CCl4
不等性杂化为三角锥 如:NH3 PCl3 H3O+
sp3d杂化:三角双锥
sp3d2杂化:八面体(等性杂化为正八面体)
是鲍林为了解释分子的立体结构提出的。中心原子杂化轨道、孤电子对数及与之相连的原子数间的关系是:杂化轨道数=孤电子对数+与之相连的原子数。杂化前后轨道总数比变,杂化轨道用来形成σ键或容纳孤对电子,未杂化的轨道与杂化轨道所在平面垂直,可用来形成π键。
常见杂化方式:
(1)sp杂化:直线型 如:CO2、CS2
(2)sp2杂化:平面三角形(等性杂化为平面正三角形) 如:BCl3 C2H4
不等性杂化为V字型 如:H2O H2S OF2
(3)sp3杂化:空间四面体(等性杂化为正四面体) 如:CH4、CCl4
不等性杂化为三角锥 如:NH3 PCl3 H3O+
sp3d杂化:三角双锥
sp3d2杂化:八面体(等性杂化为正八面体)
分子的构型与杂化类型的关系:
范德华力:
(1)概念:分子之间普遍存在的一种把分子聚集在一起的相互作用力。范德华力的作用能通常比化学键的键能小得多,一般只有2~20kJ/mol,主要影响物质的物理性质(熔、沸点和溶解度等)。
(2)规律:组成和结构相似的由分子构成的物质,相对分子质量越大,范德华力越大,物质的熔、沸点越高。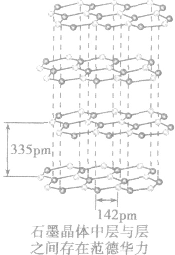
水分子间氢键的表示方法及意义:
(1)表示方法:如下图所示

(2)意义:水分子问存在氢键,使水的熔点和沸点升高,高于同主族其他元素的气态氢化物,所以常温常压下水呈液态。另外,在同态水(冰晶体)中,水分子间以氢键结合成排列规整的晶体,水分子间的氢键使冰的结构里存在较大的空隙,造成体积膨胀、密度减小至低于液态水的密度。水的这种性质对水生动物的生存有重要意义。
范德华力和氢键:
| 范德华力 | 氢键 | |
| 概念 | 把分子聚集在一起的作用力 | 分子中与氢原子形成共价键的非金属元素原子如果吸引电子的能力很强,原子半径很小,则使氢原子几乎成为“裸露”的质子,带部分正电荷,这样的分子之间氢核与带部分负电荷的非金属元素原子相互吸引,这种静电作用就是氢键 |
| 存在范围 | 分子之间 | 某些含强极性键的氢化物分子间(如 HF、H2O、NH3)等 |
| 强弱比较 | 比化学键弱得多 | 比化学键弱,但比范德华力强 |
| 影响因素 | 组成和结构相似的由分子组成的物质,相对分子质量越大,范德华力越大 | 形成氢键的除H外的非金属元素原子吸引电子的能力越强,半径越小,则氢键越强 |
| 对物质性质的影响 | 影响物质的熔沸点、溶解度等物理性质。一般来说,组成和结构相似的由分子组成的物质,随相对分子质量的增大,物质的熔沸点升高,如熔沸点: 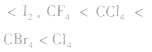 |
分子间氢键的存在,使物质的熔沸点升高,在水中的溶解度增大,如熔沸点:H2O 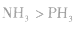 |
发现相似题
与“在半导体生产或灭火剂的使用中,会向空气逸散气体如:NF3、CH...”考查相似的试题有:
- 在半导体的生产或灭火剂的使用中,会向空气中逸散一些气体,如NF3、CHClFCF3、C3F8,它们虽是微量的,但却是强温室气体。下列...
- [化学-物质结构与性质]金属镍在电池、合金、催化剂等方面应用广泛.(1)下列关于金属及金属键的说法正确的是______.a.金属...
- Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表回答下列问题:(1)Mn元素价电子的电子排布式为______________...
- 氧是底壳中含量最多的元素。(1)氧元素基态原子核外未成对电子数为______个 。(2)H2O分子内的O-H键、分子间的范德华力和氢...
- 碳族元素包括:C、Si、 Ge、 Sn、Pb。(1)碳纳米管有单层或多层石墨层卷曲而成,其结构类似于石墨晶体,每个碳原子通过_____...
- (一)下列是A、B、C、D、E五种短周期元素的某些些性质(1)元素A是形成有机物的主要元素,下列分子中含有sp和sp3杂化方式的是_...
- 能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力。 ...
- [三选一—选修3:物质结构与性质]第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物。(1)①H、C、N、O四种元素的电负性由...
- 目前,全世界镍(Ni)的消费量仅次于铜、铝、铅、锌,居有色金属第五位,镍行业发展蕴藏着巨大的潜力。(1)配合物Ni(CO)4常...
- 乙炔是一种重要的化工原料,如图是制备乙炔及用乙炔生产其他物质的关系图。(1)由电石制乙炔的化学方程式为___。(2)基态Ca2+的...