本试题 “(1)在一定温度下,有下列反应发生:Fe2O3(s)+3CO(g)⇌2Fe(s)+3CO2(g)①该反应的平衡常数表达式K=______.②该温度下,在2L盛有Fe2O3粉末的密闭容器中...” 主要考查您对化学平衡常数
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 化学平衡常数
定义:
在一定温度下,可逆反应无论从正反应开始,还是从逆反应开始,也不管反应物起始浓度大小,最后都达到平衡,这时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值是个常数,用K表示,这个常数叫化学平衡常数。
化学表平衡达式:
对于可逆反应mA(g)+nB(g) pC(g)+qD(g)来说,化学平衡表达式:
pC(g)+qD(g)来说,化学平衡表达式: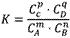
化学平衡常数的意义:
①表示该反应在一定温度下,达到平衡时进行的程度,K值越大,正反应进行的越彻底,对反应物而言转化率越高。
②某一温度下的K′与K比较能够判断反应进行的方向
K′>K,反应正向进行;K′<K,反应逆向进行;K′=K,反应处于平衡状态
(3)化学平衡常数与浓度、压强、催化剂无关,与温度有关,在使用时必须指明温度。
(4)在计算平衡常数时,必须是平衡状态时的浓度。
(5)对于固体或纯液体而言,其浓度为定值,可以不列入其中。
(6)化学平衡常数是指某一具体反应的平衡常数,若反应方向改变,则平衡常数改变,且互为倒数关系。如:在一定温度下,


化学平衡常数的应用:
1.K值越大,说明平衡体系中生成物所占的比例越大,正向反应进行的程度越大,反应物转化率越大;反之,正向反应进行的程度就越小,反应物转化率就越小,即平衡常数的大小可以衡量反应进行的程度,判断平衡移动的方向,进行平衡的相关计算。
2.若用浓度商(任意状态的生成物浓度幂之积与反应物浓度幂之积的比值,符号为Qc)与K比较,可判断可逆反应是否达到平衡状态和反应进行的方向。
3.利用K值可判断反应的热效应若升高温度,K值增大,则正反应为吸热反应;若升高温度,K值减小,则正反应为放热反应。
4.计算转化率及浓度依据起始浓度(或平衡浓度)和平衡常数可以计算平衡浓度(或起始浓度),从而计算反应物的转化率。
在一定温度下,可逆反应无论从正反应开始,还是从逆反应开始,也不管反应物起始浓度大小,最后都达到平衡,这时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值是个常数,用K表示,这个常数叫化学平衡常数。
化学表平衡达式:
对于可逆反应mA(g)+nB(g)
 pC(g)+qD(g)来说,化学平衡表达式:
pC(g)+qD(g)来说,化学平衡表达式: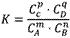
化学平衡常数的意义:
①表示该反应在一定温度下,达到平衡时进行的程度,K值越大,正反应进行的越彻底,对反应物而言转化率越高。
②某一温度下的K′与K比较能够判断反应进行的方向
K′>K,反应正向进行;K′<K,反应逆向进行;K′=K,反应处于平衡状态
(3)化学平衡常数与浓度、压强、催化剂无关,与温度有关,在使用时必须指明温度。
(4)在计算平衡常数时,必须是平衡状态时的浓度。
(5)对于固体或纯液体而言,其浓度为定值,可以不列入其中。
(6)化学平衡常数是指某一具体反应的平衡常数,若反应方向改变,则平衡常数改变,且互为倒数关系。如:在一定温度下,


化学平衡常数的应用:
1.K值越大,说明平衡体系中生成物所占的比例越大,正向反应进行的程度越大,反应物转化率越大;反之,正向反应进行的程度就越小,反应物转化率就越小,即平衡常数的大小可以衡量反应进行的程度,判断平衡移动的方向,进行平衡的相关计算。
2.若用浓度商(任意状态的生成物浓度幂之积与反应物浓度幂之积的比值,符号为Qc)与K比较,可判断可逆反应是否达到平衡状态和反应进行的方向。
3.利用K值可判断反应的热效应若升高温度,K值增大,则正反应为吸热反应;若升高温度,K值减小,则正反应为放热反应。
4.计算转化率及浓度依据起始浓度(或平衡浓度)和平衡常数可以计算平衡浓度(或起始浓度),从而计算反应物的转化率。
发现相似题
与“(1)在一定温度下,有下列反应发生:Fe2O3(s)+3CO(g)⇌2F...”考查相似的试题有:
- 对于平衡体系mA(g)+nB(g)pC(g)+qD(g);ΔHp+qB.若平衡时,A.B的转化率相等,说明反应开始A.B的物质的量之比为m∶...
- 体积完全相同的恒容容器A和B,已知A装有SO2和O2各1g,B装有SO2和O2各2g,在相同温度下反应达到平衡时A中SO2的转化率为a%,B中...
- 在容积一定的密闭容器中,进行可逆反应N2(g)+3H2(g)2NH3(g) ΔH<0,有图Ⅰ、Ⅱ所示的反应曲线(T表示温度,P表示压强,C%表示NH...
- 下列说法正确的是( )A.化学反应中化学能只可以转化为热能B.可逆反应达到平衡后,正、逆反应速率均为0C.N2和H2反应达到...
- 在一体积固定的密闭容器中充入一定量的SO2和O2,发生反应:2SO2+O2 2SO3,已知V(SO2)==0.05mol·l-1·min-1,则2min后SO3的浓...
- (7分)把0.6 mol X气体和0.6 mol Y气体混合于2 L密闭容器中,使它们发生如下反应:2X(g)+Y(g)=nM(g)+2W(g) 。2 min 末,...
- 373K时,某 1L密闭容器中加入1molPCl5发生如下可逆反应:其中物质PCl3的物质的量变化如右图所示。(1)前 20s内 PCl5(g)的...
- (1)在一定体积的密闭容器中,进行如下化学反应,CO2(g)+H2(g)CO(g)+H2O(g)。其化学平衡常数K与温度t的关系如下。请回答下列...
- (12分).在1.0 L密闭容器中放入0.10molA(g),在一定温度进行如下反应:A(g)B(g)+C(g) △H=+85.1kJ·mol-1(吸热反应)反应时间(...
- 在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表回答下列问题...