本试题 “硫酸亚铁晶体(FeSO4·7H2O)在医药上可作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下请同答下列问题:(1)步骤②加入过量H2O2的目的为________...” 主要考查您对亚铁盐(二价铁离子)
测定物质组成、成分含量
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 亚铁盐(二价铁离子)
- 测定物质组成、成分含量
浅绿色溶液,既有氧化性性又具有还原性,主要表现还原性
(1)与氧化剂反应生成三价铁 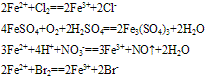
(2)与碱反应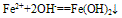
(3)Fe2+易被氧化,水溶液中易水解。亚铁盐溶液(FeCl2)在保存时加入少量铁屑以防止Fe2+被氧化,滴入少量相应的酸溶液(HCl),防止Fe2+水解。
定量实验介绍:

燃烧法测定氨基酸的组成:
实验室用燃烧法测定某种氨基酸(CxHyOzNp)的分子组成。取Wg该种氨基酸放在纯氧中充分燃烧,生成CO2、H2O和N2。现按下图所示装置进行实验。

①实验开始时,首先要通入一段时间的氧气,目的是排除体系中的N2。
②D装置的作用是吸收未反应的O2,保证最终收集的气体是N2。
③读取N2体积时,应注意:量筒内液面与广口瓶中的液面相持平视线与凹液面最低处相切。
④实验中测得N2的体积为VmL(已折算为标准状况)。为确定此氨基酸的分子式,还需要的有关数据为生成二氧化碳气体的质量、生成水的质量、氨基酸的相对分子质量
用氨气还原氧化铜的方法测定铜的近似相对原子质量:
实验室用氨气还原氧化铜的方法测定铜的近似相对原子质量,反应的化学方程式为:2NH3+3CuO
 N2+3Cu+3H2O
N2+3Cu+3H2O(1)如果选用测定反应物CuO和生成物H2O的质量[m(CuO)、m(H2O)]时,请用下列仪器设计一个简单的实验方案。
装置图:
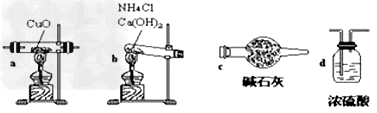
①连接顺序为:bcacd
②d中浓硫酸的作用是吸收未反应的氨、防止空气中水分进入;实验完毕时观察到a中的现象是固体由黑色转变为红色;
③Cu的相对原子质量的表达式
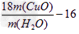
发现相似题
与“硫酸亚铁晶体(FeSO4·7H2O)在医药上可作补血剂。某课外小组测...”考查相似的试题有:
- 下图是空气氧化Fe2+为Fe3+过程中的实验结果,下列有关说法正确的是[ ]A.80℃下氧化效果较 50℃好,说明该氧化反应是吸热反应B...
- (1)阅读下面科普信息,回答问题:一个正常的成年健康人体内含铁2g,这2g铁在人体中不是以单质金属的形式存在,而是以Fe2+和...
- A、B、C、D、E、F是中学中常见的物质,其转化关系如图所示(反应条件未标出),已知反应①是置换反应。请回答下列问题:(1)若B...
- 化学与人类社会可持续发展密切相关,能源、环境、材料以及日常生活等都离不开化学.(1)硅是无机非金属材料的主角.请你举出...
- 有一包白色粉末A,由CuSO4、CaCO3、BaCl2、Na2SO4、NaOH中的两种或两种以上的物质混合而成.为探究其组成,进行如下实验(实...
- 人体呼出气体中含有N2、O2、CO2、水蒸气等多种成分。某课外学习小组利用下图装置测定N2、O2、CO2的百分含量(忽略水蒸气等微...
- 某有机物在氧气中完全燃烧只生成CO2和H2O,实验测知1.6g该有机物在氧气中燃烧后生成的产物依次通过浓硫酸和碱石灰,分别增重3...
- 某课外兴趣小组为探究某种铝合金(合金元素为Mg、Al)是否符合国家质量标准(国家规定其中铝含量不能低于78%),设计如图所示装...
- 某研究小组测定菠菜中草酸及草酸盐含量(以C2O42-计),实验步骤如下:①将菠菜样品预处理后,热水浸泡,过滤得到含有草酸及草...
- 某同学设计如下实验测量mg铜银合金样品中铜的质量分数下列说法中不正确的是[ ]A.合金的熔点比其成分金属低,通常比成分金属具...