本试题 “现有一瓶由Na+、NH4+、Cl-、NO3-、CO32-、SO42-、SO32-、OH-等离子中的某几种组成的混合物.用A、B、C三支试管,各取少量该混合液,分别进行如下实验:(1)...” 主要考查您对离子共存
离子的检验
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 离子共存
- 离子的检验
离子共存:
所谓离子共存实质上就是看离子间是否发生反应。若离子在溶液中发生反应,就不能共存。
判断离子是否共存的几种情况:
(1)发生复分解反应,离子不能大量共存。
①有气体产生 如CO32-、SO32-、S2-、HCO3-、HSO3-、HS-等易挥发的弱酸的酸根与H+不能大量共存。
②有沉淀生成 如Ba2+、Ca2+、Mg2+、Ag+等不能与SO42-、CO32-等大量共存;
Mg2+、Fe2+、Ag+、Al3+、Zn2+、Cu2+、Fe3+等不能与OH-大量共存;
Pb2+与Cl-,Fe2+与S2-、Ca2+与PO43-、Ag+与I-不能大量共存。
③有弱电解质生成 如OH-、CH3COO-、PO43-、HPO42-、H2PO4-、F-、ClO-、AlO2-、SiO32-、CN-、C17H35COO-与H+不能大量共存;
一些酸式弱酸根如HCO3-、HPO42-、HS-、H2PO4-、HSO3-不能与OH-大量共存;
NH4+与OH-不能大量共存。
(2)发生氧化还原反应,离子不能大量共存
①具有较强还原性的离子不能与具有较强氧化性的离子大量共存 如S2-、HS-、SO32-、I-和Fe3+不能大量共存。
②在酸性或碱性的介质中由于发生氧化还原反应而不能大量共存 如MnO4-、Cr2O7-、NO3-、ClO-与S2-、HS-、SO32-、HSO3-、I-、Fe2+等不能大量共存;
SO32-和S2-在碱性条件下可以共存,但在酸性条件下由于发生2S2-+SO32-+6H+=3S↓+3H2O不能共存 ;H+与S2O32-不能大量共存。
(3)能水解的阳离子跟能水解的阴离子在水溶液中不能大量共存(双水解)
例:Al3+和HCO3-、CO32-、HS-、S2-、AlO2-、ClO-等;Fe3+与CO32-、HCO3-、AlO2-、ClO-等不能大量共存。
(4)溶液中能发生络合反应的离子不能大量共存。
如Fe2+、Fe3+与SCN-不能大量共存。
主要题目要求的限定:
(1)酸性溶液(H+)、碱性溶液(OH-)、能在加入铝粉后放出可燃气体的溶液、由水电离出的H+或OH-=1×10-10mol/L的溶液等。
(2)溶液的颜色:有色离子MnO4-(紫色)、Fe3+(棕黄)、Fe2+(浅绿)、Cu2+(蓝)、Fe(SCN)2+(红)、Fe(SCN)63-(血红)。
(3)要求“大量共存”还是“不能大量共存”。
所谓离子共存实质上就是看离子间是否发生反应。若离子在溶液中发生反应,就不能共存。
因能发生氧化还原反应而不共存的离子有:
(注:“√”表示能发生反应,“×”表示不能发生反应)
|
|
S2- |
SO32- |
I- |
Fe2+ |
Br- |
Cl-(H+) |
|
MnO4- |
√ |
√ |
√ |
√ |
√ |
√ |
|
ClO- |
√ |
√ |
√ |
√ |
√ |
√ |
|
NO3-(H+) |
√ |
√ |
√ |
√ |
√ |
× |
|
Fe3+ |
√ |
√ |
√ |
× |
× |
× |
因能发生复分解反应而不共存的离子有:
- 离子间相互结合生成难溶物或微溶物
Ba2+、Ca2+ CO32-、SO32-、SO42- Ag+ CO32-、SO32-、Cl- - 离子间相互结合生成气体或挥发性物质
H+ CO32-、HCO3-、SO32-、HSO3-、S2-、HS- OH- NH4+ - 离子间相互结合生成弱电解质
H+ CO32-、SO32-、S2-、CH3COO-、F- 弱酸 OH- NH4+、Al3+、Fe3+、Cu2+、Mg2+ 弱碱 H+ 水
因能发生双水解的离子有:
| Al3+ | CO32-、HCO3-、SO32-、HSO3-、S2-、HS-、AlO2-、ClO- |
| Fe3+ | CO32-、HCO3-、AlO2-、ClO- |
| NH4+ | SiO32-、AlO2- |
因发生络合反应而不共存的离子有:
| Fe3+ | SCN- |
| Ag+、Cu2+ | NH3·H2O |
判断离子是否共存的几种情况:
(1)发生复分解反应,离子不能大量共存。
①有气体产生 如CO32-、SO32-、S2-、HCO3-、HSO3-、HS-等易挥发的弱酸的酸根与H+不能大量共存。
②有沉淀生成 如Ba2+、Ca2+、Mg2+、Ag+等不能与SO42-、CO32-等大量共存;
Mg2+、Fe2+、Ag+、Al3+、Zn2+、Cu2+、Fe3+等不能与OH-大量共存;
Pb2+与Cl-,Fe2+与S2-、Ca2+与PO43-、Ag+与I-不能大量共存。
③有弱电解质生成 如OH-、CH3COO-、PO43-、HPO42-、H2PO4-、F-、ClO-、AlO2-、SiO32-、CN-、C17H35COO-与H+不能大量共存;
一些酸式弱酸根如HCO3-、HPO42-、HS-、H2PO4-、HSO3-不能与OH-大量共存;
NH4+与OH-不能大量共存。
(2)发生氧化还原反应,离子不能大量共存
①具有较强还原性的离子不能与具有较强氧化性的离子大量共存 如S2-、HS-、SO32-、I-和Fe3+不能大量共存。
②在酸性或碱性的介质中由于发生氧化还原反应而不能大量共存 如MnO4-、Cr2O7-、NO3-、ClO-与S2-、HS-、SO32-、HSO3-、I-、Fe2+等不能大量共存;
SO32-和S2-在碱性条件下可以共存,但在酸性条件下由于发生2S2-+SO32-+6H+=3S↓+3H2O不能共存 ;H+与S2O32-不能大量共存。
(3)能水解的阳离子跟能水解的阴离子在水溶液中不能大量共存(双水解)
例:Al3+和HCO3-、CO32-、HS-、S2-、AlO2-、ClO-等;Fe3+与CO32-、HCO3-、AlO2-、ClO-等不能大量共存。
(4)溶液中能发生络合反应的离子不能大量共存。
如Fe2+、Fe3+与SCN-不能大量共存。
主要题目要求的限定:
(1)酸性溶液(H+)、碱性溶液(OH-)、能在加入铝粉后放出可燃气体的溶液、由水电离出的H+或OH-=1×10-10mol/L的溶液等。
(2)溶液的颜色:有色离子MnO4-(紫色)、Fe3+(棕黄)、Fe2+(浅绿)、Cu2+(蓝)、Fe(SCN)2+(红)、Fe(SCN)63-(血红)。
(3)要求“大量共存”还是“不能大量共存”。
离子的检验:
(1)焰色反应:Na+:黄色;K+:紫色(透过蓝色钴玻璃观察);Ca2+:砖红色;
(2)H+:H+酸性。遇紫色石蕊试液变红,遇湿润蓝色石蕊试纸变红;
(3)NH4+:在试液中加强碱(NaOH)加热,产生使湿润红色石蕊试纸变蓝的气体;NH4++OH-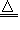 NH3↑+H2O;NH3+H2O
NH3↑+H2O;NH3+H2O
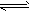 NH3?H2O
NH3?H2O NH4++OH-
NH4++OH-
(4)Fe3+:①通KSCN或NH4SCN溶液呈血红色:Fe3++SCN-==[Fe(SCN)]2+;②通NaOH溶液红褐色沉淀:Fe3++3OH-==
Fe(OH)3↓
(5)Fe2+:①遇NaOH溶液生成白色沉淀在空气中迅速转化成灰绿色最后变成红褐色沉淀:Fe3++2OH-=Fe(OH)2↓;
4Fe(OH)2+O2+2H2O==4Fe(OH)3;
②试液中加KSCN少量无明显变化再加氯水出现血红色: 2Fe2++Cl2==2Fe3++2Cl-;Fe3++SCN-==[Fe(SCN)]2+
(6)Mg2+:遇NaOH溶液有白色沉淀生成,NaOH过量沉淀不溶解:Mg2++2OH-==Mg(OH)2↓,但该沉淀能溶于NH4Cl溶液;
(7)Al3+:遇NaOH溶液(适量)有白色沉淀生成,NaOH溶液过量沉淀溶解:Al3++3OH-==Al(OH)3↓;Al(OH)3+OH-==
AlO2-+2H2O
(8)Cu2+:遇NaOH溶液有蓝色沉淀生成,加强热变黑色沉淀:Cu2++2OH-==Cu(OH)2↓;Cu(OH)2 CuO+H2O
CuO+H2O
(9)Ba2+:遇稀H2SO4或硫酸盐溶液有白色沉淀生成,加稀HNO3沉淀不溶解:Ba2++SO42-==BaSO4↓
(10)Ag+: ①加NaOH溶液生成白色沉淀,此沉淀迅速转变为棕色沉淀溶于氨水Ag++OH-==AgOH↓;2AgOH==Ag2O+H2O;AgOH+2NH3?H2O==[Ag(NO3)2]OH+2H2O
②加稀HCl或可溶性氧化物溶液再加稀HNO3生成白色沉淀:Ag++Cl-==AgCl↓
(11)OH-:OH-碱性:①遇紫色石蕊试液变蓝;②遇酚酞试液变红;③遇湿润红色石蕊试纸变蓝;
(12)Cl-:遇AgNO3溶液有白色沉淀生成,加稀HNO3沉淀不溶解:Ag++Cl-=AgCl↓
(13)Br-:加AgNO3溶液有浅黄色沉淀生成,加稀HNO3沉淀不溶解:Ag++Br-=AgBr↓
(14)I-: ①加AgNO3溶液有黄色沉淀生成,加稀HNO3沉淀不溶解:Ag++I-=AgI↓;②加少量新制氯水后再加淀粉溶液显蓝色:2I-+Cl2=I2+2Cl-;I2遇淀粉变蓝
(15)S2-:①加强酸(非强氧化性)生成无色臭鸡蛋气味气体:S2-+2H+=H2S↑;②遇Pb(NO3)2或(CH3COO)2Pb试液生成黑色沉淀,遇CuSO4试液产生黑色沉淀:Pb2++S2-=PbS↓;Cu2++S2-=CuS↓
(16)SO42-:加可溶性钡盐[BaCl2或Ba(NO3)2]溶液有白色沉淀生成后再加稀HCl或稀HNO3沉淀不溶解:Ba2++SO42-=BaSO4↓
(17)SO32-:加强酸(H2SO4或HCl)把产生气体通入品红溶液中,品红溶液褪色:SO32-+2H+=H2O+SO2↑ SO2使品红溶液褪色
(18)CO32-:加稀HCl产生气体通入澄清石灰水,石灰水变浑浊:CO32-+2H+=H2O+CO2↑;CO2+Ca(OH)2=CaCO3↓+H2O
(19)HCO3-:取含HCO3-盐溶液煮沸,放出无色无味、使澄清石灰水变浑浊的气体;或向HCO3-溶液里加入稀MgSO4溶液,无现象,加热煮沸有白色沉淀MgCO3生成,同时放出CO2气体。
(20)NO3-:浓缩试液加稀硫酸和铜片加热有红棕色气体产生,溶液变成蓝色:
Cu+4H++2NO3-=Cu2++2NO2↑+2H2O
(21)PO43-:加AgNO3溶液产生黄色沉淀,再加稀HNO3沉淀溶解:3Ag++PO43-=Ag3PO4↓;Ag3PO4溶于稀HNO3酸。
(1)焰色反应:Na+:黄色;K+:紫色(透过蓝色钴玻璃观察);Ca2+:砖红色;
(2)H+:H+酸性。遇紫色石蕊试液变红,遇湿润蓝色石蕊试纸变红;
(3)NH4+:在试液中加强碱(NaOH)加热,产生使湿润红色石蕊试纸变蓝的气体;NH4++OH-
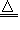 NH3↑+H2O;NH3+H2O
NH3↑+H2O;NH3+H2O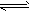 NH3?H2O
NH3?H2O NH4++OH-
NH4++OH- (4)Fe3+:①通KSCN或NH4SCN溶液呈血红色:Fe3++SCN-==[Fe(SCN)]2+;②通NaOH溶液红褐色沉淀:Fe3++3OH-==
Fe(OH)3↓
(5)Fe2+:①遇NaOH溶液生成白色沉淀在空气中迅速转化成灰绿色最后变成红褐色沉淀:Fe3++2OH-=Fe(OH)2↓;
4Fe(OH)2+O2+2H2O==4Fe(OH)3;
②试液中加KSCN少量无明显变化再加氯水出现血红色: 2Fe2++Cl2==2Fe3++2Cl-;Fe3++SCN-==[Fe(SCN)]2+
(6)Mg2+:遇NaOH溶液有白色沉淀生成,NaOH过量沉淀不溶解:Mg2++2OH-==Mg(OH)2↓,但该沉淀能溶于NH4Cl溶液;
(7)Al3+:遇NaOH溶液(适量)有白色沉淀生成,NaOH溶液过量沉淀溶解:Al3++3OH-==Al(OH)3↓;Al(OH)3+OH-==
AlO2-+2H2O
(8)Cu2+:遇NaOH溶液有蓝色沉淀生成,加强热变黑色沉淀:Cu2++2OH-==Cu(OH)2↓;Cu(OH)2
 CuO+H2O
CuO+H2O (9)Ba2+:遇稀H2SO4或硫酸盐溶液有白色沉淀生成,加稀HNO3沉淀不溶解:Ba2++SO42-==BaSO4↓
(10)Ag+: ①加NaOH溶液生成白色沉淀,此沉淀迅速转变为棕色沉淀溶于氨水Ag++OH-==AgOH↓;2AgOH==Ag2O+H2O;AgOH+2NH3?H2O==[Ag(NO3)2]OH+2H2O
②加稀HCl或可溶性氧化物溶液再加稀HNO3生成白色沉淀:Ag++Cl-==AgCl↓
(11)OH-:OH-碱性:①遇紫色石蕊试液变蓝;②遇酚酞试液变红;③遇湿润红色石蕊试纸变蓝;
(12)Cl-:遇AgNO3溶液有白色沉淀生成,加稀HNO3沉淀不溶解:Ag++Cl-=AgCl↓
(13)Br-:加AgNO3溶液有浅黄色沉淀生成,加稀HNO3沉淀不溶解:Ag++Br-=AgBr↓
(14)I-: ①加AgNO3溶液有黄色沉淀生成,加稀HNO3沉淀不溶解:Ag++I-=AgI↓;②加少量新制氯水后再加淀粉溶液显蓝色:2I-+Cl2=I2+2Cl-;I2遇淀粉变蓝
(15)S2-:①加强酸(非强氧化性)生成无色臭鸡蛋气味气体:S2-+2H+=H2S↑;②遇Pb(NO3)2或(CH3COO)2Pb试液生成黑色沉淀,遇CuSO4试液产生黑色沉淀:Pb2++S2-=PbS↓;Cu2++S2-=CuS↓
(16)SO42-:加可溶性钡盐[BaCl2或Ba(NO3)2]溶液有白色沉淀生成后再加稀HCl或稀HNO3沉淀不溶解:Ba2++SO42-=BaSO4↓
(17)SO32-:加强酸(H2SO4或HCl)把产生气体通入品红溶液中,品红溶液褪色:SO32-+2H+=H2O+SO2↑ SO2使品红溶液褪色
(18)CO32-:加稀HCl产生气体通入澄清石灰水,石灰水变浑浊:CO32-+2H+=H2O+CO2↑;CO2+Ca(OH)2=CaCO3↓+H2O
(19)HCO3-:取含HCO3-盐溶液煮沸,放出无色无味、使澄清石灰水变浑浊的气体;或向HCO3-溶液里加入稀MgSO4溶液,无现象,加热煮沸有白色沉淀MgCO3生成,同时放出CO2气体。
(20)NO3-:浓缩试液加稀硫酸和铜片加热有红棕色气体产生,溶液变成蓝色:
Cu+4H++2NO3-=Cu2++2NO2↑+2H2O
(21)PO43-:加AgNO3溶液产生黄色沉淀,再加稀HNO3沉淀溶解:3Ag++PO43-=Ag3PO4↓;Ag3PO4溶于稀HNO3酸。
发现相似题
与“现有一瓶由Na+、NH4+、Cl-、NO3-、CO32-、SO42-、SO32-、OH-...”考查相似的试题有:
- 下列各组离子在溶液中能大量共存,且溶液为无色透明的离子组是[ ]A.B.C.D.
- 水溶液X中只可能溶有K+、Mg2+、Al3+、AlO-2、SiO2-3、SO2-3、CO2-3、SO2-4中的若干种离子.某同学对该溶液进行了如图所示实验...
- 下列各组离子在指定溶液中能大量共存的是A.在无色溶液中:Na+、Cu2+、NO3―、MnO4―B.在含有HCO3-的溶液中:H+、K+、SO42―、...
- 列各组离子一定能在指定环境中大量共存的是( )A.在c(H+)=10-10mol/L的溶液中 Al3+、NH、Cl-、NOB.pH值为13的溶液 K+、SO...
- 下列各组中,离子能大量共存的是( )A.NH4+、 Na+、SO42-、OH-B.NH4+、H+、 Cl-、CO32-C.K+、 NH4+、 NO3-、 Cl-D.Ca2+、N...
- 室温下,下列各组离子在指定溶液中一定能大量共存的是[ ]A.饱和氯水中B.溶液中C.pH=13的溶液中D.由水电离溶液中
- 下列除去杂质的方法正确的是 A.除去BaSO4中的少量BaCO3:加入足量盐酸,充分反应后,过滤、洗涤、干燥B.除去KCl溶液中的少...
- 在某未知溶液中加入硝酸银溶液有白色沉淀生成,加入稀硝酸后,沉淀部分溶解,有无色无味的气体生成,将气体通入澄清石灰水中...
- 某溶液中可能含有Ba2+、I-、NH4+、Cu2+、SO32-,向该溶液中加入少量溴水,溶液仍呈无色,则下列关于该溶液组成的判断正确的是...
- (10分)海水中化学资源的综合开发利用已受到各国的高度重视。Br2和Mg等两种单质都可以从海水中提取,下图为提取它们的步骤:请...