本试题 “【化学——选修2:化学与技术】(15分)自来水生产的流程示意图见下:(1)混凝剂除去悬浮物质的过程 (填写序号)①只是物理变化 ②只是化学变化 ③是物理和化学...” 主要考查您对化学与技术
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 化学与技术
化学技术在工农业生产有重要应用:
1.应用合成氨技术生产铵态氮肥,有利于农业生产;工业上生产磷肥、钾肥等。

2.接触法制硫酸,有利于工业生产。
(1)原料:主要有黄铁矿、硫黄等。
(2)原理:以黄铁矿为原料生产硫酸为例,生产主要经过三个阶段。
(3)有关反应

工业上并不直接用水吸收三氧化硫,而是用质量分数为98.3%的浓硫酸作吸收剂,因为三氧化硫与水蒸气容易形成酸雾,从而降低三氧化硫的吸收率。同时采用逆流吸收,硫酸从塔底放出。
3.工业上制取纯碱--联合之间法
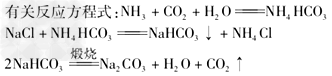
1.应用合成氨技术生产铵态氮肥,有利于农业生产;工业上生产磷肥、钾肥等。

2.接触法制硫酸,有利于工业生产。
(1)原料:主要有黄铁矿、硫黄等。
(2)原理:以黄铁矿为原料生产硫酸为例,生产主要经过三个阶段。
(3)有关反应

工业上并不直接用水吸收三氧化硫,而是用质量分数为98.3%的浓硫酸作吸收剂,因为三氧化硫与水蒸气容易形成酸雾,从而降低三氧化硫的吸收率。同时采用逆流吸收,硫酸从塔底放出。
3.工业上制取纯碱--联合之间法
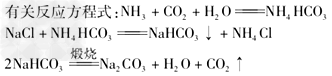
发现相似题
与“【化学——选修2:化学与技术】(15分)自来水生产的流程示意图...”考查相似的试题有:
- 用阿司匹灵治疗头痛、防治心脏病和中风已有百年历史。伦敦帝国学院和哈默史密斯医院前列腺生物学小组的医生们进行的最新研究...
- (12分)随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金的维生素”。为回收利用含钒催化剂(含...
- 铝是地壳中含量最多的金属元素,1854年法国化学家德维尔用金属钠还原氯化钠和氯化铝的复盐,获得了铝单质。1886年,美国人豪...
- 当液态空气温度升高达到刚沸腾时,在蒸发出的气体中[ ]A.基本上不含氧气B.氮气占体积的78%C.基本上不含氮气D.氮气含量稍...
- “氢能”将是未来最理想的新能源。Ⅰ.实验测得,1 g氢气燃烧生成液态水时放出142.9kJ热量,则氢气燃烧的热化学方程式为_______...
- 利用转炉煤气[CO(60~80%)、CO2(15~20%)及微量N2等]及硫酸工业尾气中的SO2,既能净化尾气,又能获得保险粉(Na2S2O4),其...
- 以黄铁矿为原料,采用接触法生产硫酸的流程可简示如下:请回答下列问题:(1)在炉气制造中,生成SO2的化学方程式为___________...
- 全球金融危机对纺织企业带来了严重影响。而纺织业,开发新型产品,占据市场制高点是抵抗金融危机最有效的办法。下列是某纺织...
- 工业上合成氨的原料之一为氢气,其来源之一是利用石油气的有关成分如丙烷(C3H8)制取。以下途径,假设反应都能进行,从经济效益考...
- 下列反应属于人工固氮的是( )A.N2和O2在雷电的作用下生成NOB.NO和O2反应生成NO2C.N2和H2反应生成NH3D.NO2和H2O反应生成...